
在含有1 mol FeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤,然后在空气中灼烧沉淀,得到的固体物质是( )
A.Fe B.FeO C.Fe(OH)3 D.Fe2O3
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
向足量H2SO4溶液中加入100mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1HCl溶液时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为 ( )
A.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-73 kJ·mol-1
D.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-0.72 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:填空题
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择)。
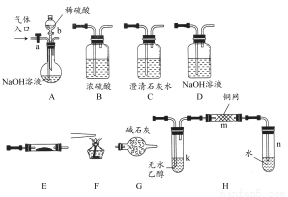
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为________(填字母),能验证CO氧化产物的现象是________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A―→E―→D―→B―→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应________,活塞b应________,需要加热的仪器装置有________(填代号),m中反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:填空题
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生产中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中含有的大量阳离子是________。
(2)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下所示。
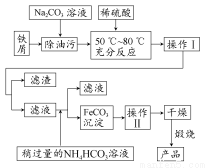
回答下列问题:
①操作Ⅰ所用的分离仪器的名称是________;操作Ⅱ的名称是________,该操作的具体方法是________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________。
③请写出生成FeCO3沉淀的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:选择题
下列实验中,溶液颜色有明显变化的是( )
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO4溶液中
D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:实验题
某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
反应进程 (分钟) | 1 | 2 | 5 | 15 | 20 |
4.0 mol/L 盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
2.0 mol/L 硫酸 | 无明显现象 | 极少量 气泡 | 少量气泡 | ||
4.0 mol/L 硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
请回答下列问题:
(1)写出铝与盐酸反应的离子方程式: 。
(2)反应在1~15min内,铝与盐酸的反应速率逐渐增大,其原因是 。
(3)根据以上探究“铝与稀盐酸和稀硫酸的反应速率存在差异的原因”,你能对原因作出哪些假设或猜想: (写出一种即可)。
Ⅱ.乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表:
实验目的 | 实验 编号 | 温度 /℃ | 金属铝的 形态 | 盐酸浓度 /mol·L-1 |
1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验①和③探究温度对该反应速率的影响; 3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响 | ① | 25 | 铝片 | 4.0 |
② |
|
|
| |
③ |
|
|
| |
④ |
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:选择题
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
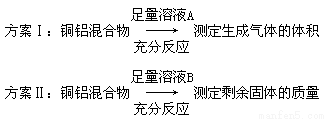
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:选择题
下列各组中的两种物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.NaHCO3和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-1 化学与工农业生产练习卷(解析版) 题型:选择题
自来水加工处理流程如下,下列有关说法不正确的是( )
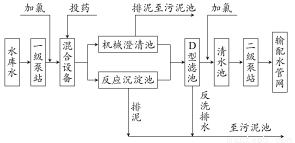
A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池
B.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等
C.自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染
D.用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com