
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
分析 ①c=$\frac{1000ρω}{M}$;
②m=ρVω;
③c=$\frac{1000ρω}{M}$,则ω=$\frac{cM}{1000ρ}$;
④c=$\frac{1000×\frac{m(溶液)}{V}×\frac{m(溶质)}{m(溶液)}}{M}$.
解答 解:①c=$\frac{1000ρω}{M}$=$\frac{1000dw%}{{M}_{r}}$=$\frac{10dw}{{M}_{r}}$,故错误;
②m=ρVω=dV×w%,故正确;
③c=$\frac{1000ρω}{M}$,则ω=$\frac{cM}{1000ρ}$=$\frac{c{M}_{r}}{1000ρ}$,故错误;
④c=$\frac{1000×\frac{m(溶液)}{V}×\frac{m(溶质)}{m(溶液)}}{M}$=$\frac{1000m}{{M}_{r}V}$,故正确;
故选B.
点评 本题考查物质的量浓度、质量分数等有关计算,为高频考点,明确各个物理量之间的关系是解本题关键,侧重考查学生对基本公式的掌握和运用,注意单位换算,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:实验题
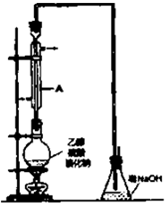 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量就等于物质的式量 | |
| B. | 摩尔质量就是物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | H2SO4和H3PO4的摩尔质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别胶体与浊液(丁达尔效应) | B. | 高压除尘(电泳现象) | ||
| C. | 河海交汇处可沉积沙洲(聚沉) | D. | 喷雾剂的应用(布朗运动) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023 | |
| B. | 标准状况下,aL的氧气和氮气的混合物含有的分子数约为a/22.4×6.02×1023 | |
| C. | 常温常压下,48g O3气体含有的氧原子数为6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y | B. | Z>X>Y | C. | X>Y>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com