
| A. | Fe-Zn合金 | B. | Fe-Cu合金 | C. | Fe-Mg合金 | D. | Mg-Al合金 |
分析 假设金属和酸反应都生成+2价离子,n(H2)=$\frac{0.1g}{2g/mol}$=0.05mol,反应中生成H2和消耗金属的物质的量相等,则金属的物质的量为0.05mol,则金属M=$\frac{2g}{0.05mol}$=40g/mol,只有Ca的摩尔质量是40g/mol,如果金属的摩尔质量不是40g/mol,则一种金属的摩尔质量大于40g/mol、一种金属的摩尔质量小于40g/mol,和稀盐酸不反应的金属其摩尔质量无穷大,Al如果为+2价时其摩尔质量为18g/mol.
解答 解:假设金属和酸反应都生成+2价离子,n(H2)=$\frac{0.1g}{2g/mol}$=0.05mol,反应中生成H2和消耗金属的物质的量相等,则金属的物质的量为0.05mol,则金属M=$\frac{2g}{0.05mol}$=40g/mol,只有Ca的摩尔质量是40g/mol,如果金属的摩尔质量不是40g/mol,则一种金属的摩尔质量大于40g/mol、一种金属的摩尔质量小于40g/mol,和稀盐酸不反应的金属其摩尔质量无穷大,Al如果为+2价时其摩尔质量为18g/mol,
A.Fe、Zn的摩尔质量分别是56g/mol、64g/mol,都大于40g/mol,不符合条件,故A错误;
B.金属铜不能与盐酸反应产生H2,所以其摩尔质量相当于无限大,Fe的摩尔质量为56g/mol,都大于40g/mol,不符合条件,故B错误;
C.Fe的摩尔质量为56g/mol、Mg的摩尔质量为24g/mol,一个大于40g/mol、一个小于40g/mol,符合条件,故C正确;
D.Mg、Al(+2价)的摩尔质量分别为24g/mol、18g/mol,都小于40g/mol,不符合条件,故D错误;
故选C.
点评 本题考查混合物有关计算,为高频考点,采用极限法分析解答,注意Cu、Al摩尔质量的处理方法,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 物质(杂质) | 试剂 | 有关化学方程式 |
| SiO2(Al2O3) | ||
| FeCl2(FeCl3) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油主要是各种烷烃、环烷烃、烯烃组成的混合物 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
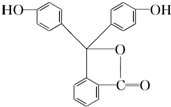 酚酞是中学化学中常用的酸碱指示剂,其结构如下,完成下列问题:
酚酞是中学化学中常用的酸碱指示剂,其结构如下,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有强氧化性,稀H2SO4完全没有氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应 | |
| D. | 在受热的情况下浓硫酸也能与铁、铝发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
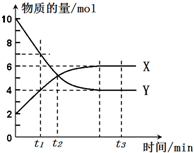 一定温度下,在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.
一定温度下,在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com