
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.1 mol Cl2与足量的Fe充分反应,转移电子的数目为3NA
B.常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA
C.常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.1 mol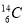 原子中所含中子数目为6NA
原子中所含中子数目为6NA
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4 L气体
B.2 L 0.05 mol/L乙酸溶液中H+数为0.1NA
C.等物质的量的Na2O和Na2O2中含有的阴离子总数不同
D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市、石嘴山市高三四月联考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为 (用元素符号表示)。
(3)BD32-中心原子杂化轨道的类型为________杂化;CA4+的空间构型为__________(用文字描述)。
(4)1mol BC-中含有π键的数目为______NA。
(5)D、E元素最简单氢化物的稳定性 _____> _____ (填化学式),理由是 。
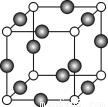
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 _____ ,C原子的配位数是 _____。若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为______g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:推断题
(15分)化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下:
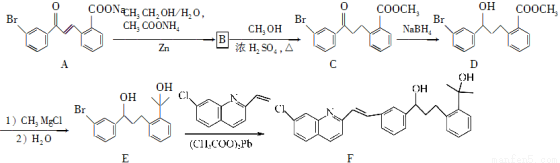
请回答下列问题:
(1)化合物C中含氧官能团为________、________(填名称)。
(2)化合物B的分子式为C16H13O3Br,则B的结构简式为____________。
(3)由C→D、E→F的反应类型依次为________、________。
(4)写出符合下列条件C的一种同分异构体的结构简式:______________。
Ⅰ.属于芳香族化合物,且分子中含有2个苯环;
Ⅱ.能够发生银镜反应;
Ⅲ.分子中有5种不同环境的氢原子。
(5)已知:RCl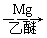 RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、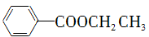 为原料制备
为原料制备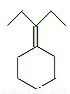 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
H2C=CH2 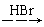 CH3CH2Br
CH3CH2Br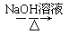 CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列关于各图象的解释或得出的结论正确的是
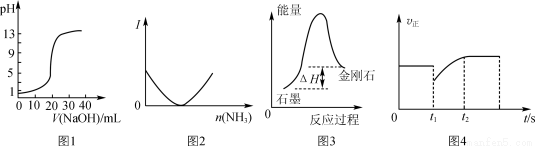
A.图1表示用0.10 mol·L-1 NaOH溶液滴定20.00 mL 0.10 mol·L-1醋酸溶液的滴定曲线
B.图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化
C.根据图3所示可知:石墨比金刚石稳定
D.图4表示反应2SO2+O2 2SO3,t1时刻只减小了的SO3的浓度
2SO3,t1时刻只减小了的SO3的浓度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:实验题
B.[实验化学]卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化。某实验小组通过如下实验对卷心菜中维生素C的含量进行测定。
第一步:配制维生素C标准溶液。将5片100 mg的维生素C药片碾碎、溶解,配成250 mL标准溶液。
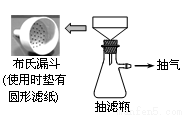
第二步:制取卷心菜汁。取50 g新鲜的卷心菜,捣烂,加水充分搅拌,用下图所示装置抽滤制得卷心菜汁50 mL。
第三步:标准溶液中维生素C含量的测定。移取20.00 mL维生素C标准溶液于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V1。
第四步:卷心菜汁中维生素C含量的测定。移取20 mL卷心菜汁于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V2。
(1)与过滤相比,抽滤的优点是 。抽滤所用的滤纸应略 (填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。
(2)移取20.00 mL待测液选用的仪器是 ,滴定终点溶液的颜色呈 色。
(3)上述滴定过程滴定速度要快,否则将会使测得的维生素C的含量偏低,其可能的原因是 。
(4)1kg卷心菜中所含维生素C相当于 片上述维生素药片。(用含V1、V2的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:
A(g)+B(g) 2C(g)+D(s) △H=a kJ·mol-1
2C(g)+D(s) △H=a kJ·mol-1
实验内容和结果分别如下表和下图所示。下列说法正确的是
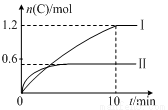
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 1.5 mol | 0.5 mol | —— |
A.实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B.上述方程式中a=-160
C.600 ℃时,该反应的平衡常数是0.45
D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:填空题
选考[化学—选修2:化学与技术](15分)工业合成氨技术是对人类的巨大贡献之一。下面是合成氨的简要流程示意图:
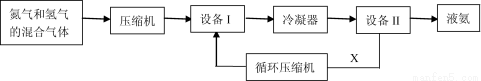
(1)设备I的名称是 ,沿X路线循环的物质是 (填字母)。
A.N2和H2 B.催化剂 C.NH3 D.N2、H2和NH3
(2)合成氨中H2可以由焦炭和水蒸汽反应获得。请写出该反应的化学方程式:_______。
(3)原料气中往往含有H2S、CO、CO2等杂质,必须除去这些杂质的目的是 ,常用K2CO3溶液除去CO2,其反应的离子方程式为 。
(4)近年有人将电磁场直接加在氮气和氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较高的产率。电磁场对合成氨反应本质的影响是_______,该方法的优点是_________________。
(5)合成氨工业往往含有大量含氨废水,为了防止对环境造成污染,可以利用电解法将NH3·H2O转化为对环境无污染的加以处理。电解时以石墨做电极,以硝酸作为电解质,则理论上处理1mol NH3·H2O,电路中转移电子 mol,阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
(14分)“海底黑烟囱”是海底热泉将地壳深处金属、非金属化合物带出时逐渐沉积形成的烟囱状通道,含有铜、锌、锰、钻、镍等金属的硫化物及金、银、铂等贵金属。“海底黑烟囱”的研究对海底矿产资源的勘探及金属硫化物成矿过程的认识均有极大的推动作用。
(1)“烟囱”周围的水样中发现了中子数是1,质子数是2的核素,该核素符号是 。
(2)“烟囱”内壁含有的结晶黄铁矿(主要成分是FeS2)在一定条件下发生如下反应:
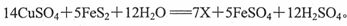 X的化学式是 ,氧化剂是 。
X的化学式是 ,氧化剂是 。
(3)“烟囱”外壁含有石膏(CaS04-2H20),在1400 0C时能分解生成CaO,水蒸气和另外两种气体,其中一种气体可使品红溶液褪色。写出1400℃时石膏分解的化学方程式 。
(4)“烟囱”底部存在的难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS)。根据沉淀溶解平衡理论写出由ZnS转化为CuS的离子方程式 ;
若转化后溶液中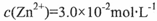 ,则c(Cu2+)= mol·L-1〔已知
,则c(Cu2+)= mol·L-1〔已知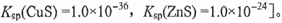
(5)“烟囱”中含有钻元素,LiCoO2可用作一种铿离子电池的正极材料。该锉离子电池充电过程中,负极发生的反应为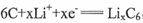 ,正极发生
,正极发生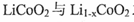 之间的转化,写出放电时电池总反应方程式 。
之间的转化,写出放电时电池总反应方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com