
(6分)卤族元素包括F、Cl、Br、I等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 (填写序号)。

(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷。
①下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,
该功能陶瓷的化学式为 ;

②第一电离能介于B、N之间的第二周期元素有 种。
(3)ZnCl2与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有σ键的物质的量为 。
(1)a(1分)(2)①2(1分)BN(1分) ②3(1分) (3)16mol(2分)
【解析】
试题分析:(1)a.同一主族中,元素的电负性随着原子序数的增大而减小,所以从氟到溴,其电负性逐渐减小,故正确;b.氟元素没有正化合价,第VIIA族氯、溴元素的最高化合价数值等于其族序数,故错误;c.第VIIA族元素氢化物的沸点随着相对分子质量的增大而增大,但HF分子间能形成氢键,氢键属于特殊的分子间作用力,强度大于分子间作用力,沸点最高,故错误;d.由于卤族元素的单质均属于分子晶体,随相对分子质量增大范德华力增大,因而沸点逐渐升高,故错误;故选a;
(2)①B的原子半径比N大,因而结构示意图中大球代表B原子,B原子个数=8× +1=2,N原子个数=1+4×
+1=2,N原子个数=1+4× =2,该晶胞中N原子和B原子个数之比=2:2=1:1,所以其化学式为BN。
=2,该晶胞中N原子和B原子个数之比=2:2=1:1,所以其化学式为BN。
②同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素。
(3)在该化合物中N与H之间含有3个σ键,另外N与Zn之间含有配位键,所以1mol该配合物中含有σ键的物质的量为1×4+3×4=16mol。
考点:考查原子杂化方式、电负性、第一电离能、配位键、晶胞的计算等


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:2014年高中化学人教版选修四第一章 化学反应与能量练习卷(解析版) 题型:选择题
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014年甘肃省第二学期第二学段段中考试化学(理科)试卷(解析版) 题型:填空题
(8分)写出下列相应的化学方程式
(1)乙烯→乙醇: (2)丙烯→聚丙烯:
(3)苯→溴苯: (4)苯→环己烷:
查看答案和解析>>
科目:高中化学 来源:2014年甘肃省第二学期第二学段段中考试化学(理科)试卷(解析版) 题型:选择题
下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2 CH3CHBrCH2Br ②CH3CH2OH
CH3CHBrCH2Br ②CH3CH2OH  CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O ④ CH3Cl+Cl2→CH2Cl2+HCl
CH3COOCH2CH3+H2O ④ CH3Cl+Cl2→CH2Cl2+HCl
A. ①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2014年7月山东省泰安市高二年级考试化学(物质结构与性质)试卷(解析版) 题型:填空题
(7分)金属及其化合物在生产、生活中有广泛应用。
(1)从结构角度分析Fe3+较Fe2+稳定的原因。
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体属于 晶体。
(3)铁元素为血红蛋白和肌红蛋白的活性部分———血红素的重要组成元素,血红素的结构简式如下图所示。与铁原子形成配位键的是 号氮原子(填写氮原子标号)。
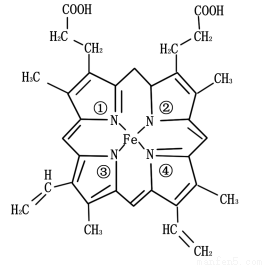
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,更适合作录音带磁粉原料的是(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014年7月山东省泰安市高二年级考试化学(物质结构与性质)试卷(解析版) 题型:选择题
下列说法正确的是(NA为阿伏加德罗常数)
A.124gP4含有P—P键的个数为4NA
B.12g石墨中含有C—C键的个数为3NA
C.12g金刚石中含有C—C键的个数为2NA
D.60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源:2014年7月山东省泰安市高二年级考试化学(物质结构与性质)试卷(解析版) 题型:选择题
用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
A.CS2是V形分子 B.SnBr2键角大于120°
C.BF3是三角锥形分子 D.NH4+键角等于109.5°
查看答案和解析>>
科目:高中化学 来源:2014年7月山东省泰安市高二年级考试化学(有机化学基础)试卷(解析版) 题型:选择题
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

有关上述反应物和产物的叙述正确的是
A. 上述反应类型为取代反应
B. 按碳的骨架分类,上述三种有机物均属于芳香烃
C. 1mol乙酰水杨酸最多能与含2mol NaOH的水溶液发生反应
D. 贝诺酯分子中有三种不同类型的含氧官能团
查看答案和解析>>
科目:高中化学 来源:2014年7月山东省泰安市高一年级考试化学试卷(解析版) 题型:选择题
下列反应既是氧化还原反应,又是吸热反应的是
A. 锌粒与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的碳与CO2反应 D. 葡萄糖在人体内氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com