
 W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ĵ縺����ͬ��������Ԫ�������
W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ĵ縺����ͬ��������Ԫ����������� W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ�W��һ�ֺ��ص�������Ϊ18��������Ϊ10������������Ϊ18-10=8����WΪOԪ�أ�X��Neԭ�ӵĺ�����������1����ԭ�Ӱ뾶������������XΪNaԪ�أ�Y�ĵ�����һ�ֳ����İ뵼����ϣ�ԭ����������Na����YΪSi��Z�ĵ縺����ͬ��������Ԫ���������ZΪ�ڢ���A��Ԫ�أ�ԭ����������Si������ZΪClԪ�أ��ݴ˽��
��� �⣺W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ�W��һ�ֺ��ص�������Ϊ18��������Ϊ10������������Ϊ18-10=8����WΪOԪ�أ�X��Neԭ�ӵĺ�����������1����ԭ�Ӱ뾶������������XΪNaԪ�أ�Y�ĵ�����һ�ֳ����İ뵼����ϣ�ԭ����������Na����YΪSi��Z�ĵ縺����ͬ��������Ԫ���������ZΪ�ڢ���A��Ԫ�أ�ԭ����������Si������ZΪClԪ�أ�
��1��XΪNaԪ�أ�λ��Ԫ�����ڱ��е������ڵ�IA�壻WΪOԪ�أ���������Ų�Ϊ1s22s22p4��ԭ�Ӻ�����2��δ�ɶԵ��ӣ��ʴ�Ϊ������IA��2��
��2��X�ĵ���Ϊ�ƣ����ڽ������壬�����۵�Ƚϵͣ�Y�ĵ���Ϊ����裬����ԭ�Ӿ��壬�۵�ܸߣ����۵�ϸߵ���Si�����ڷǽ�����Cl��Br�����⻯���ȶ���HCl��HBr��
�ʴ�Ϊ��Si��HCl��
��3��Y��Z�γɵĻ�����ΪSiCl4��������ˮ��Ӧ������һ�������һ��ǿ�ᣬӦ���ɹ�����HCl���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�SiCl4+3H2O=H2SiO3��+4HCl��
�ʴ�Ϊ��SiCl4+3H2O=H2SiO3��+4HCl��
��4��Y�ǹ�Ԫ�أ���ΪSiH4+2O2�TSiO2+2H2O��8e-�����ԣ�����1mol����ת��ʱ���μӷ�Ӧ��SiH4Ϊ$\frac{1mol}{8}$����1molSiH4��Ӧʱ���ų�����Ϊ190.0kJ��8=1520.0 kJ�����ȷ�Ӧ����ʽΪ��SiH4��g��+2O2��g���TSiO2��s��+2H2O��l����H=-1520.0 kJ•mol-1��
�ʴ�Ϊ��SiH4��g��+2O2��g���TSiO2��s��+2H2O��l����H=-1520.0 kJ•mol-1��
���� ���⿼��λ�ýṹ���ʹ�ϵӦ�ã��ƶ�Ԫ���ǽ���ؼ������ضԻ�ѧ����Ŀ��飬������ѧ���Ի���֪ʶ�Ĺ��̣��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| M | |
| T |
 ��Ԫ��W�����ڱ��е�λ���ǵ������ڵڢ�A�壮
��Ԫ��W�����ڱ��е�λ���ǵ������ڵڢ�A�壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
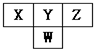 ��ͼ�����ڱ��ж����ڵ�һ���֣���֪Y��Wԭ�����γ��������������к����壬������˵���в���ȷ���ǣ�������
��ͼ�����ڱ��ж����ڵ�һ���֣���֪Y��Wԭ�����γ��������������к����壬������˵���в���ȷ���ǣ�������| A�� | ԭ�Ӱ뾶�Ĵ�С˳����W��Y��Z | |
| B�� | X���⻯��û��Z���⻯���ȶ� | |
| C�� | ZԪ�ص�����������ˮ�����������ǿ | |
| D�� | Y���⻯���W���⻯��е�ߣ�����Ϊ���Ӽ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3COOH ��Һ��ˮϡ�ͺ���Һ��$\frac{c��CH3COOH��}{c��CH3COO-��}$ ��ֵ��С | |
| B�� | ��֪һ���¶��£�������Һ�����ʵ���Ũ��Ϊc�������Ϊ����Ka=$\frac{{{{��c����}^2}}}{c��1-����}$�����������������ƹ��壬��CH3COOH?CH3COO-+H+�����ƶ�������С��Ka��С | |
| C�� | ʵ���û����飨l��������ϩ��l���ͱ���l���ı�ȼ���ȷֱ�Ϊ-3916 kJ/mol��-3747 kJ/mol��-3265 kJ/mol������֤���ڱ������в����ڶ�����̼̼˫�� | |
| D�� | ��֪��Fe2O3��s��+3C��ʯī���T2Fe��s��+3CO��g������H=+489.0 kJ/mol�� CO��g��+$\frac{1}{2}$O2��g���TCO2��g������H=-283.0 kJ/mol�� C��ʯī��+O2��g���TCO2��g������H=-393.5 kJ/mol�� ��4Fe��s��+3O2��g���T2Fe2O3��s������H=-1641.0 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������Һʱ�а�ɫ������˵����Һ�к���Cl- | |
| B�� | ����BaCl2������ɫ����������ϡ����ܽ⣬˵����Һ�к���SO42- | |
| C�� | ����NaOH��Һ�����Ȳ�����ɫ�̼�����ʹʪ��ĺ�ɫʯ����ֽ���������壬˵����Һ��һ������NH4+ | |
| D�� | ��������������Һʱ���а�ɫ�������ɣ��ټ�ϡ����ʱ����ɫ�����ܽ⣬������ʹ����ʯ��ˮ����ǵ���ɫ��ζ���壬����Һ��һ������CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com