
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒,其中N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )

A. 该反应的还原剂是Cl-
B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6mol电子
D. 氧化剂与还原剂的物质的量之比为2∶3
科目:高中化学 来源: 题型:
【题目】1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol
B.C(s)+ ![]() O2(g)=CO(g)△H=﹣393.5 kJ/mol
O2(g)=CO(g)△H=﹣393.5 kJ/mol
C.C+O2=CO2△H=﹣393.5 kJ/mol
D.C(s)+O2(g)=CO2(g)△H=﹣393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如下图所示.若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( ) ![]()
A.氢化物稳定性:X>Y
B.最高价氧化物对应的水化物的酸性:W>Y
C.4种元素的单质中,W单质的熔、沸点最高
D.干燥的W单质具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯氧化法制备苯甲酸的反应原理如下: 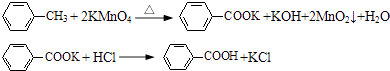
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯.
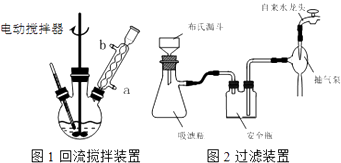
(1)实验室中实现操作Ⅰ所需的玻璃仪器有、烧杯;操作Ⅱ的名称为 .
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 .
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是;如图2所示抽滤完毕,应先断开橡皮管.
(4)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10﹣3 mol.产品中苯甲酸质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
(1)化学键断裂需要(填“释放”或“吸收”)能量;
(2)图中表示了吸收和释放的能量,其中释放的能量共kJ;
(3)该反应的反应物的总能量(填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是(填“放热”或“吸热”)反应;
(4)用图示数据计算其反应热,写出该反应的热化学方程式 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法正确的是( ) 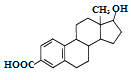
A.该有机物的分子式为C19H22O3
B.该分子中所有碳原子不可能在同一个平面内
C.能发生加成反应、取代反应、水解反应
D.能与Na、NaOH溶液反应,但不能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( ) 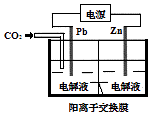
A.Pb与电源的正极相连
B.ZnC2O4在离子交换膜右侧生成
C.正极反应式为:Zn﹣2e﹣═Zn2+
D.标准状况下,当11.2 L CO2参与反应时,转移0.5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某化合物X受热分解:2X=A↑+2B↑+4C↑。测得反应后生成的混合气体对H2的相对密度为d,在相同条件下,X的相对分子质量是
A. 2d B. 7d C. 5d D. 3.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
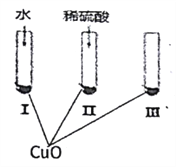
(1)通过实验I可以证明___________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入__________,再加入_________。
(3)探究结果为__________ 。
(4)反应的离子方程式为__________。
【答案】 水不能使氧化铜溶解 可溶性硫酸盐 稀硫酸 H+能溶解氧化铜,而H2O、SO42-两种离子都不能使CuO溶解 CuO+2H+=Cu2++H2O
【解析】(1)实验Ⅰ的试管中的液体成分为水,该实验证明水不溶解CuO;
(2)要想证明起作用的是H+,首先要排除SO42-的干扰,所以在Ⅲ中应该加入可溶性硫酸盐,如Na2SO4(或K2SO4等),最后再加放稀硫酸;
(3)通过对比实验验证起作用的成分,得出结论是:氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用,而H2O、SO42-两种粒子都不能使CuO溶解;
(4)CuO与硫酸电离的氢离子反应生成铜离子和水,反应的离子方程式为:CuO+2H+=Cu2++H2O。
点睛:性质实验方案设计的一般思路、程序是: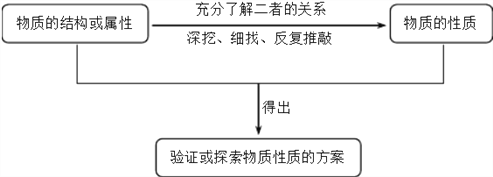 。
。
【题型】实验题
【结束】
28
【题目】(1)己知: 将Cl2通入适量KOH 溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-):c(C1O-)的值与温度高低有关。当n(KOH)=amol时,若某温度下,反应后c(Cl-):c(C1O-)=11,则溶液中c(ClO-):c(ClO3-)=__________。
(2)在P+CuSO4+H2O→CuP+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4 可氧化P的物质的量为_______mol。生成1molCu3P时,参加反应的P 的物质的量为_______mol。
(3)一定量的CuS和Cu2S 的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-) 加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO16.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V的极小值为______L。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol/L 硝酸的溶液100mL,恰好使混合物全部溶解,且放出336mLNO (标准状况下),向所得溶液中加入KSCN 溶液,溶液无红色出现; 若取相同质量的Fe、FeO、Fe3O4的混合物,加入1mol/L 的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com