
【题目】高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:
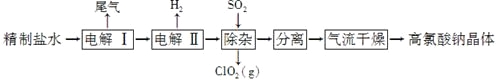
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是________________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有______________(填化学式)。“电解Ⅱ”的化学方程式为_____________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为_______________________。“气流干燥”时,温度控制在80~100 ℃的原因是__________________。
【答案】除去Ca2+和引入的Ba2+ 电解时Br-被氧化 Cl2 NaClO3+H2O![]() NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 温度太高,高氯酸钠晶体失去结晶水或分解;温度太低,干燥不充分
NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 温度太高,高氯酸钠晶体失去结晶水或分解;温度太低,干燥不充分
【解析】
(1)粗盐的提纯中:Ca2+用CO32-除去、Mg2+用OH-除去、SO42-用Ba2+除去,除杂过程中过量除杂试剂必须除去,过量NaOH用盐酸除去,过量的Ba2+用CO32-除去,过量CO32-用盐酸除去,碳酸钠的作用除去Ca2+和引入的Ba2+,根据电解池的放电顺序,放电顺序:Br->Cl-,除去Br-,在电解过程中直接电解Cl-,节省电能,因此原因:电解时Br-被氧化;
(2)根据题意,在阳极上Cl-放电生成ClO3-,也有可能放电生成Cl2,阴极上2H2O+2e-=H2↑+2OH-,尾气中除含有氢气外,可能含有氯气,电解Ⅱ产生高氯酸钠,阳极上电极反应式:ClO3-+H2O-2e-=ClO4-+2H+,阴极上电极反应式:2H++2e-=H2↑,两式合并:ClO3-+H2O![]() ClO4-+H2↑,反应方程式:NaClO3+H2O
ClO4-+H2↑,反应方程式:NaClO3+H2O![]() NaClO4+H2↑;
NaClO4+H2↑;
(3)根据信息:SO2被氧化,ClO3-→ClO2,ClO3-+SO2→ClO2↑+SO42-,根据化合价升降法配平,其离子反应方程式为:2ClO3-+SO2=2ClO2+SO42-,实验目的是制备NaClO4·H2O,温度过高,高氯酸钠晶体会失去结晶水,或温度过高,高氯酸钠分解,如果温度过低,干燥不充分。


科目:高中化学 来源: 题型:
【题目】湿垃圾又称为厨余垃圾,厨余垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。 下列说法正确的是( ).
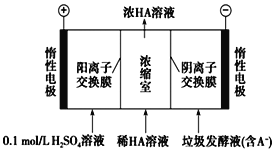
A.当有11.2LO2生成时,电路中通过2 mol e-的电量
B.电子从负极经电解质溶液回到正极
C.通电后,A-通过阴离子交换膜从阴极区进入浓缩室
D.通电后,阳极附近pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )

A.盐酸中逐滴加入食盐溶液
B.醋酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.醋酸中逐滴加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36g炭不完全燃烧所得气体中CO和CO2的体积比为1:2。已知:
C(s)+1/2O2(g) === CO(g); △H1=-110.35kJ/mol
CO(g)+1/2O2(g) === CO2(g);△H2=-282.57kJ/mol
则与36g炭完全燃烧相比,损失的热量是( )
A.392.93kJB.282.57kJC.784.92kJD.3274.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用2a molL﹣1NaOH溶液滴定1.0L2a molL﹣1氢氟酸溶液,得到混合液中HF、F﹣的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
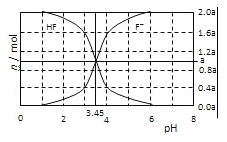
A.pH=3时,溶液中:c(Na+)<c(F﹣)
B.c(F﹣)>c(HF)时,溶液一定呈碱性
C.pH=3.45时,NaOH溶液恰好与HF完全反应
D.pH=4时,溶液中:c(HF)+c(Na+)+ c(H+)-c(OH﹣)<2amolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2molH2完全燃烧生成水蒸气放出热量484kJ,且1molH-H键断裂时吸收热量为436kJ,1molO=O键断裂时吸收热量为496kJ,则水蒸气中1molH-O键形成时放出的热量为_____。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已达化学平衡的反应:2X(g)+Y(g)![]() 2Z(g),减小压强后,对反应产生的影响是
2Z(g),减小压强后,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动
D.逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为3mol的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,以C表示的平均速率v(C)=0.25molL-1min-1,下列说法正确的是( )
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,以C表示的平均速率v(C)=0.25molL-1min-1,下列说法正确的是( )
A.反应速率v(B)=0.25molL-1min-1
B.该反应方程式中,x=1
C.2min时,A的物质的量为1.5mol
D.2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钛广泛用于耐高温、耐磨损及航空航天等领域。一种氮化钛的制备反应为:6TiCl4+8NH3=6TiN+24HCl+N2,回答下列问题:
(1)钛在元素周期表中的位置为_____________,基态Ti原子价层电子的轨道表达式为________。
(2)氮可与其他元素形成正离子,如NH4Cl中的NH4+,N2O5中的NO2+。组成这两种正离子的元素中第一电离能由小到大的顺序为____________;NH4+的空间构型为___________;NO2+中氮原子的杂化形式为_______,其中σ键与π键的数目比为_________。
(3)四氯化钛晶体的熔点为-23℃,沸点为136℃,则TiCl4晶体的类型为___________,该晶体中微粒之间的作用力为___________。
(4)一种TiN金黄色晶体晶胞结构与NaCl相同(如图),该晶胞中N原子数目为_______;该氮化钛的密度为5.4g/cm3,则其晶胞参数a=___________pm(用NA表示阿伏加德常数的数值,只列算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com