
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 碳酸钠可作胃酸的中和剂 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 利用明矾溶液的酸性清除铜镜表面的铜锈 |
分析 A.小苏打可生成二氧化碳气体;
B.碳酸钠碱性较强,具有腐蚀性;
C.血液透析原理即为渗析原理;
D.明矾中的铝离子水解显酸性.
解答 解:A.小苏打受热能分解生成二氧化碳气体,可用于面包发酵粉,故A正确;
B.碳酸钠碱性较强,具有腐蚀性,具有腐蚀性,一般用碳酸氢钠或氢氧化铝作胃酸的中和剂,故B错误;
C.血液透析原理即为渗析原理,血液是胶体,胶粒不能透过半透膜,故C正确;
D.明矾中的铝离子水解显酸性,酸性溶液能溶解铜锈,所以利用明矾溶液的酸性能清除铜镜表面的铜锈,故D正确.
故选B.
点评 本题综合考查元素化合物性质与用途,侧重化学与生活的考查,题目有利于学生的良好的科学素养的培养,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
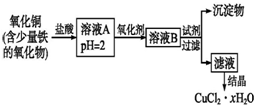 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将铁钉投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 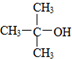 的命名:2,2-二甲基-2-乙醇 的命名:2,2-二甲基-2-乙醇 | |
| C. | 常温下,浓度都为0.1mol•Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 | |
| D. | 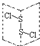 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com