
| A、①④②③⑤ |
| B、①④⑤③② |
| C、①②④⑤③ |
| D、①⑤③②④ |


科目:高中化学 来源: 题型:
| A、利用生物质能就是间接利用太阳能 |
| B、生物质能是可再生的能源 |
| C、生物质能是解决农村能源的重要途径 |
| D、生物质能的缺点是严重污染环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14C原子与C60中普通碳原子的化学性质不同 |
| B、14C原子与14N原子所含中子数相同 |
| C、是C60的同素异形体 |
| D、与12C、13C是碳元素的三种同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量SO2气体通入氨水中:SO2+2NH3+H2O═2NH 4 ++SO32-+H2O |
| B、向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2═2Ee3++I2+4Cl |
| C、向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-═BaCO3↓+2H2O+CO32- |
| D、硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I═Fe2++5I2+3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

A、0-t1时,v(Y)=
| ||
| B、t2时刻改变的条件可能是压强或催化剂 | ||
| C、该反应的正反应为放热反应 | ||
| D、该反应中Z一定为产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
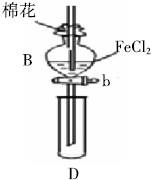 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 既有Fe3+又有Fe2+ | 有SO42- |
| 乙 | 有Fe3+ 无Fe2+ | 有SO42- |
| 丙 | 有Fe2+ 无Fe3+ | 有Fe2+ |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com