
用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此铅氧化物的化学式是 ( )
A.PbO B.Pb2O3
C.Pb3O4 D.PbO2
科目:高中化学 来源: 题型:
向含有1mol的FeCl2溶液中通入0.2molCl2,再加入含0.1mol X2O72- 的酸性溶
液,使溶液中Fe2+全部恰好氧化,并使 X2O72- 还原为Xn+,则n值为
 A.2 B.3 C.4 D.5
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
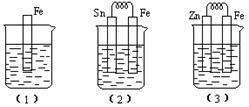
如下图所示,烧杯中都盛有稀硫酸:
① 装置(2)中Fe电极的电极反应:
,
装置(3)中Fe电极的电极反应:
;
② 装置(2)Sn极附近溶液的pH ;(填:“增大”、“减小”或“不变”)
③ 比较(1)、(2)、(3)中铁被腐蚀的速率由快到慢的顺序是 。(填“序号”)
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
ⅰ.高温下用碳还原二氧化硅制得粗硅
ⅱ.粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HCl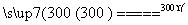 SiHCl3+H2
SiHCl3+H2
ⅲ.SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第ⅰ步制备粗硅的化学反应方程式为___________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点
57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为______________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
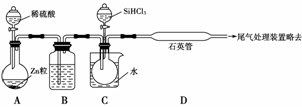
①装置B中的试剂是____________________________________________________。
装置C中的烧瓶需要加热,其目的是__________________________________ _____。
_____。
②反应一段时间后,装置D中观察到的现象是_______________________________,
装置D不能采用普通玻璃管的原因是_______________________________________,
装置D中发生反应的化学方程式为_________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是______(填写字母代号)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液
e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于SiO2和CO2的叙述中不正确的是 ( )
A.都是共价化合物
B.都是酸性氧化物,都能与强碱溶液反应
C.都能溶于水且与水反应生成相应的酸
D.SiO2可用于制光导纤维,干冰可用于人工降雨
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3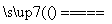 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
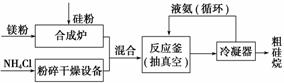
①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是______________________________________
________________________________________________________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式________________________________________________________________________,
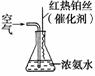 实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
(2 )三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________
)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________
____________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液
30 mL,则Mg2Si3O8·nH2O中的n值为__________。(注:Mg2Si3O8的摩尔质量为
260 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如下图所示。由此可知原溶液中
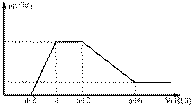 A.不含SO42-
A.不含SO42-
B.含有的阴离子一定是OH-、AlO2-、SiO32-
C.含有的阴离子一定是OH-、CO32-、AlO2-、SiO32-
D.含有AlO2-与SiO32-的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子反应方程式正确的是( )
A.铜粉与98.3%的硫酸加热下反应:Cu+4H++SO ===Cu2++SO2↑+2H2O
===Cu2++SO2↑+2H2O
B.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O―→C6H5 OH+HSO
C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO +2H2O+4NH
+2H2O+4NH
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2===2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是
( )
 干海带
干海带 海带灰
海带灰 悬浊液
悬浊液 滤液
滤液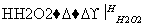 碘水
碘水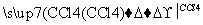 I2的CCl4溶液
I2的CCl4溶液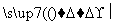 I2
I2
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com