
钱逸泰教授等以CCl4和金属钠为原料,制造出纳米级金刚石粉末。下列说法错误的是
A.纳米级金刚石粉末属于胶体 B.制造过程元素种类没有改变
C.金属钠在反应过程中被氧化 D.该反应是置换反应
科目:高中化学 来源: 题型:
下列关于 的说法正确的是
A、所有原子可能都在同一平面上 B、最多只可能有9个碳原子在同一平面
C、有7个碳原子可能在同一直线 D、只可能有5个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.第IA族元素的金属性一定比IIA族元素的金属性强
B.第三周期中的非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱
C.非金属元素之间只能形成共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、
C分别为四个电极,当闭合开关后,则以下叙述正确的是
A.C电极为电解池的阳极
B.Cu电极附近OH—浓度增大
C.Na+移向Pt电极
D.Pt电极上有O2生成

查看答案和解析>>
科目:高中化学 来源: 题型:
下列方程式不能正确解释实验事实的是
A.0.l mol·L-l CH3COOH溶液的pH >1: CH3COOH  CH3COO-+H+
CH3COO-+H+
B.Na2 CO3溶液能使酚酞试液变红:CO32- +H2O  HCO3-+OH-
HCO3-+OH-
C.铁溶于稀硝酸,溶液变黄:3Fe +8H+ +2NO3- 3Fe2++2NO↑+4H2O
D.向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀:
3Mg(OH)2(s)+2Fe3+(aq) 2Fe( OH)3(s)+3Mg2+(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如右图所示。下列判断不正确的是
A.该实验方案的缺陷之一是未做空白对照实验
B.Cu2+、Mn2+提高乙酸降解速率的最佳浓度为
0.1 mmol·L-l
C.Fe3+不能提高乙酸降解速率
D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的
 降解速率依次减小
降解速率依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是

A.在第③、④、⑤步骤中,溴元素均被氧化
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.制取NaHCO3的反应是利用其溶解度小于NaCl
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)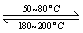 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+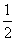 O2(g)==CO(g)
O2(g)==CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)==CO2(g)  H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)==SO2(g)  H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= 。
H= 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时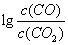 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
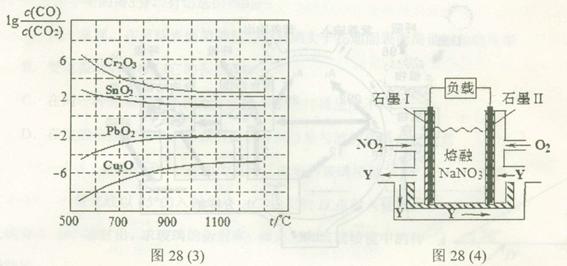
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com