
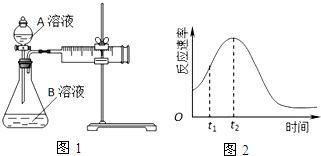
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
| ② | 20mL 0.2mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
分析 (1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,根据得失电子守恒、电荷守恒配平离子方程式;
(2)对比①②实验可探究草酸浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
(3)先求出反应的n(MnO4-)的物质的量,再求出反应后的浓度;
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;
(5)根据反应过程中反应物浓度在减小,要加快反应的条件还可能是温度和催化剂的作用.
解答 解:(1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4的比例关系为:2:5,再根据电荷守恒配平离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,相同时间所得CO2的体积大,
故答案为:浓度;<;
(3)CO2的物质的量为:$\frac{2.24×1{0}^{-3}L}{22.4L•mo{l}^{-1}}$=0.0001mol,设2min末,反应消耗的n(MnO4-)为x,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0001mol
解得 x=0.00002mol
反应剩余的高锰酸根离子的物质的量为:30×10-3L×0.01mol•L-1-0.00002mol=0.00028mol
c(MnO4-)=$\frac{n}{V}$=$\frac{0.00028mol}{0.05L}$=0.0056mol/L;
故答案为:0.0056;
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,
故答案为:KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间;
(5)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:
①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
②产物Mn2+是反应的催化剂,
故答案为:该反应放热;产物Mn2+是反应的催化剂.
点评 本题考查了影响化学反应速率的因素,注意掌握影响化学反应速率的因素,明确探究影响化学反应速率因素的方法,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和环氧丙烷在催化作用下可生成一种可降解的高聚物,可减少二氧化碳对环境的影响 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
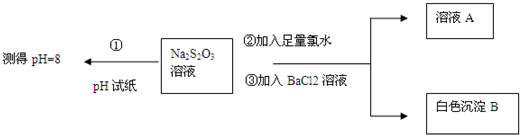
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
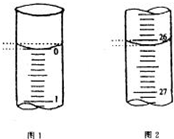 中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>W>Y>X | |
| B. | X的简单氢化物与足量W单质在光照条件下反应生成物均为气体 | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | Y的最高价氧化物对应的水化物可与其简单氢化物发生化合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com