
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
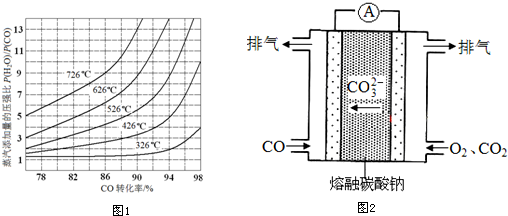
分析 (1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物和质量恒定律分析解题;
(2)根据平衡常数的表达式推断;应用盖斯定律来求△H3;
(3)平衡常数随温度的变化来判断正反应方向是吸热还是放热,应用三行式结合平衡常数来求转化率;
(4)将化学平衡常数中的浓度c换成压强P就可以得到KP;根据平衡常数只与温度有关,与浓度无关;投料比太低,CO的转化率不太高,投料比太高,经济上不合算以及考虑催化剂的活性来解答;
(5)负极发生氧化反应.
解答 解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,所以该反应的方程式为CO(g)+H2(g)?C(s)+H2O(g),故答案为:CO(g)+H2(g)?C(s)+H2O(g);
(2)根据化学方程式可知:K1=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$,K2=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$,K3=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$,所以:K3=K1×K2;由①+②可得方程式C(s)+H2O(g)?CO(g)+H2(g),所以△H3=(a+b)kJ/mol,故答案为:K3=K1×K2;(a+b)kJ/mol;
(3)由图可知温度越高K值越小,说明正反应为放热反应,
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以$\frac{c×c}{(0.02-c)×(0.02-c)}$=9,解得c=0.015
所以CO的转化率为$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:放热;75%;
(4)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=$\frac{P(C{O}_{2})P({H}_{2})}{P(CO)P({H}_{2}O)}$;平衡常数只与温度有关,与浓度无关,所以提高$\frac{{H}_{2}O(g)}{CO}$比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5:1时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右,所以一般采用400℃左右,H2O(气):CO=3~5;
故答案为:$\frac{P(C{O}_{2})P({H}_{2})}{P(CO)P({H}_{2}O)}$;不变;①该温度下催化剂活性最大 ②该压强比下,反应物转化率已经接近98%;
(5)负极发生氧化反应,CO-2e-+CO32-=2CO2,故答案为:CO-2e-+CO32-=2CO2.
点评 本题考查了反应的平衡常数和盖斯定律、图象分析判断的方法、平衡三段法的计算、原电池原理的分析判断和电极反应的分析判断,掌握基础是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇 | B. | 醋酸 | C. | 一氯甲烷 | D. | 三氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
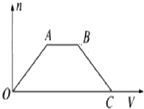 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )| A. | ②⑤ | B. | ⑤④ | C. | ④② | D. | ④① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
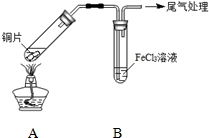 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3均只能与酸反应,不能与碱反应 | |
| B. | Na和Fe在一定条件下与水反应都生成H2和对应的碱 | |
| C. | Mg和Al都可以用电解法冶炼得到 | |
| D. | Na2O和Na2O2与CO2反应产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0 | B. | 0.25a | C. | 0.45a | D. | 0.50a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com