
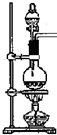
| A. | 利用浓硫酸的吸水性和氧化性 | |
| B. | 开始制备气体时应先加热后向烧瓶中加硫酸 | |
| C. | 利用浓硫酸的难挥发性和酸性 | |
| D. | 组装完实验装置立即加试剂、加热制气体 |
分析 实验室用氯化钠和浓硫酸混合加热的方法制取氯化氢气体,该反应的化学方程式为:2NaCl+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑,
A.反应中没有元素化合价的变化;
B.加完液体再加热;
C.浓硫酸具有难挥发性和酸性,HCl属于易挥发性强酸;
D.组装完装置后要检验装置的气密性.
解答 解:实验室用氯化钠和浓硫酸混合加热的方法制取氯化氢气体,该反应的化学方程式为:2NaCl+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑,
A.反应中没有元素化合价的变化,浓硫酸没有表现氧化性,故A错误;
B.开始制备气体时应先加硫酸后加热,如果先加热后向烧瓶中加硫酸,会导致烧瓶炸裂,故B错误;
C.浓硫酸具有难挥发性和酸性,HCl属于易挥发性强酸,制备原理是利用难挥发性酸制备易挥发性酸,故C正确;
D.组装完装置后要检验装置的气密性,防止装置不严密,使气体泄漏污染环境,故D错误.
故选C.
点评 本题考查了HCl气体的制备,把握实验原理是解题的关键,题目难度不大,侧重于考查学生的实验探究能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H+十SO42-→BaSO4↓+2H2O | |
| B. | CuSO4溶液与NaOH溶液反应:Cu2++2OH-→Cu(OH)2↓ | |
| C. | NaOH溶液中通入少量CO2:2OH-+CO2→CO32-+H2O | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-→H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同种原子 | B. | 同种元素 | ||
| C. | 互为同位素 | D. | 具有相同的核外电子排布 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
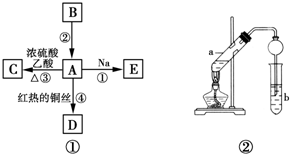
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
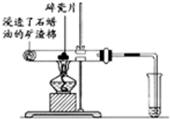 (1)写出下列反应的化学方程式:
(1)写出下列反应的化学方程式: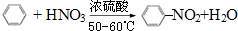 .
.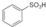 ),根据质量守恒定律,可判断出另一个反应产物为H2O.
),根据质量守恒定律,可判断出另一个反应产物为H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H6(l)+7.5O2(g)→6CO2(g)+3H2O(l)+41.8kJ | |
| B. | C6H6(l)+7.5O2(g)→6CO2(g)+3H2O(l)+3260.4kJ | |
| C. | 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+41.8kJ | |
| D. | 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+3260.4kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.
;液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基、甲基电子数相同 | |
| B. | 所有烃基和苯基都不是官能团 | |
| C. | 甲醛和一氯甲烷在常温下呈气态,而溴乙烷、苯甲酸、饱和高级脂肪酸甘油酯在常温 下呈液态 | |
| D. | 不含羟基和羧基的有机物水溶性都较差 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com