
下列示意图与对应的反应情况正确的是
A B C D
A.含0.01molKOH 和0.01mol Ca(OH)2 的混合溶液中缓慢通入CO2
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2 溶液
C. n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
D.n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.硫酸铝溶液中加入过量氨水
Al3++3OH-====Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水
Ca(OH)2+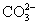 ====CaCO3↓+2OH-
====CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气
Cl2+2OH-====ClO-+Cl-+H2O
D.稀硫酸中加入铁粉
2Fe+6H+====2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是( )
A、1mol氯气参加氧化还原反应,转移的电子数一定为2 NA
B、0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA
C、常温常压下,44g二氧化碳分子中所形成的共用电子对数为2 NA
D、常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写不正确的是
A.单质铜与稀硝酸反应:Cu + 2 H+ + 2 NO3- ==Cu2+ + 2 NO↑+ H2O
B.NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3- + 2OH- + Ca2+==CaCO3↓+ 2H2O
C.等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2+ + 2Br - + 2Cl2==2Fe3+ + Br2 + 4Cl -
D.氨水吸收少量的二氧化硫:2NH3·H2O + SO2==2NH4+ +SO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
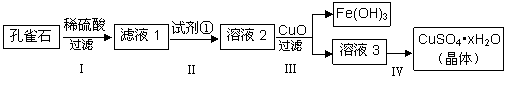 孔雀石主要成分是Cu2(OH)2CO3,还含少量难溶的FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
孔雀石主要成分是Cu2(OH)2CO3,还含少量难溶的FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
(1)步骤Ⅰ中涉及的反应用离子方程式表示为_____________________________。
(2)为将溶液中Fe2+氧化成Fe3+步骤Ⅱ中加入的试剂①最好是__________(填代号)。
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅳ获得硫酸铜晶体,需要经过_________、_________、过滤等操作。
(4)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____________。
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.5g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g。则计算得x=______
查看答案和解析>>
科目:高中化学 来源: 题型:
铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是( )
A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶
B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬
C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性
D.1 mol 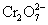 得到6 mol电子时,还原产物是Cr3+
得到6 mol电子时,还原产物是Cr3+
查看答案和解析>>
科目:高中化学 来源: 题型:
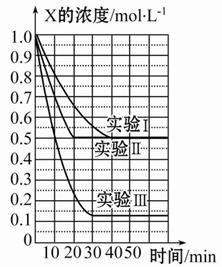
某同学在三个容积相同的密闭容器中,分别研究三种不同条件下化学反应2X(g) Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )
Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )
A.与实验Ⅰ相比,实验Ⅱ可能使用了催化剂
B.与实验Ⅰ相比,实验Ⅲ若只改变温度,则温度T1<T2,该反应是吸热反应
C.在实验Ⅰ、Ⅱ、Ⅲ中,达到平衡状态时X的体积百分含量相同
D.若起始浓度c(X)=0.8 mol·L-1,c(Y)=c(W)=0,其余条件与实验Ⅰ相同,则平衡浓度c(X)=0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
为研究盛装浓硫酸的铁质材料(碳素钢)与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)实验:称取铁钉5.6 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用
(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取448 mL(标准状况)气体Y通入足量溴水中,发生的反应式为:Br2+SO2+2H2O====2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为 。
(2)提出猜想:分析上述实验中SO2体积分数的结果,同学们认为气体Y中还可能含有其他气体并作如下猜想:
猜想一:Y气体中可能含有H2;
猜想二: ;
猜想三: 。
(3)设计实验,验证猜想:为验证以上猜想,同学们准备用下列装置设计探究实验(装置可重复使用,夹持仪器省略)。
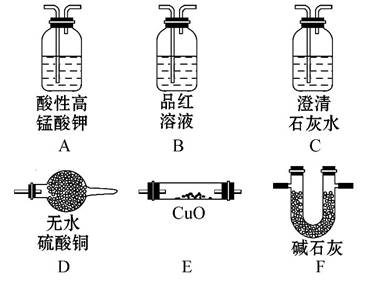
①实验装置的连接顺序为A→ → →F→ → __________→F(填字母)。
②装置B中试剂的作用是 。
③猜想一的理由是
(用化学方程式表示)。
④如果猜想一成立,预计实验现象应该是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com