
| A. | 根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 | |
| C. | 晶体中一定存在化学键 | |
| D. | 正四面体分子中键角只能是109°28′ |
分析 A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素;
B.氟元素没有正价;
C.稀有气体为氮原子分子,分子间通过分子间作用力形成分子晶体;
D.白磷是正四面体结构,但是键角60°.
解答 解:A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,所以P元素第一电离能大于S元素,故A正确;
B.氟元素只有负价,没有正价,故B错误;
C.稀有气体为分子晶体,不存在化学键,故C错误;
D.白磷是正四面体结构,但是键角60°,故D错误;
故选:A.
点评 本题为综合题,考查了第一电离能大小判断、元素化合价与族序数的关系、化学键、键角等知识点,题目难度中等,侧重考查学生对物质结构和元素周期律等基本理论的考查,注意一般规律中的异常现象.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
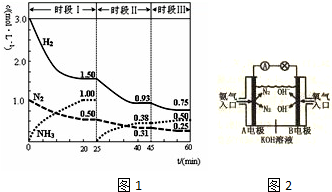
 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中C、H、O原子个数比为1:4:1 | |
| B. | 该有机物分子中C、H原子个数比为1:4 | |
| C. | 该有机物中必定含有氧元素 | |
| D. | 该有机物化学式为CH4O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
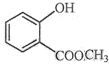 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.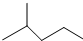 表示的分子式为C6H14;2-甲基-2-丁烯的结构简式为CH3C (CH3)=CHCH3.
表示的分子式为C6H14;2-甲基-2-丁烯的结构简式为CH3C (CH3)=CHCH3. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和水 | B. | 熟石灰和水 | C. | 生石灰和水 | D. | 氯化钠和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.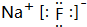 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
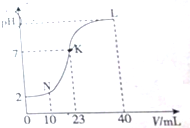
| A. | K点时的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N点时的溶液:2c(M+)=c(A-) | |
| C. | L点时的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水电离的程度:K>L>N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com