
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小
C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,促进水的电离平衡
D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
用如图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的
是( )
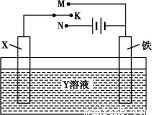
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+O2=N2+2H2O。下列关于该电池工作时说法中正确的是( )
A.正极的电极反应式:O2+4H++4e-=2H2O
B.溶液中的阴离子向正极移动
C.负极的电极反应式:N2H4+4OH--4e-=4H2O+N2
D.溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:填空题
A、B、C、D分别为NH4HSO4、Ba(OH)2、AlCl3、Na2CO3 4种物质中的1种,溶于水均完全电离,现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a________b(填“>”“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为________(填化学式)。
(3)C溶液与D溶液反应的离子方程式为__________________________________________
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为________________________________________________________________________。
(5)已知沉淀甲的Ksp=x。将0.03 mol·L-1的A溶液与0.01 mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为________(用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
A.在500 ℃、20 MPa、5 L的密闭容器中进行合成氨的反应,使用催化剂后K值增大
B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
C.25 ℃时,pH 均为4的盐酸和NH4I(aq)中KW不相等
D.2SO2+O2 2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
某温度下,向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为( )
2SO3(g)的平衡常数为( )
A.3.2×103 B.1.6×103 C.8.0×102 D.4.0×102
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
下列关于C、Si、S、Cl 4种元素的说法中,正确的是( )
A.在自然界中都能以游离态存在
B.两两结合形成的化合物都是共价化合物
C.氢化物的热稳定性比较:CH4<SiH4<H2S<HCl
D.最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:简答题
硼元素在化学中有很重要的地位。硼的化合物在农业、医药等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式________________________________________________________________________。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是________________________________________________________________________________________________________________________________________________。
(3)在BF3分子中中心原子的杂化轨道类型是________,SiF4粒子的空间构型是________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-后者却是生成SiF62-:________________________________________________________________________
________________________________________________________________________。
(4)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com