
【题目】有下列化合物:①NH4Al(SO4)2、②NH4HSO4、③NH4Cl、④NH3H2O、⑤CH3COONH4, 回答下列问题。
(1)NH4HSO4 的电离方程式为_____
(2)等浓度的②④⑤三种溶液中,NH4+浓度由大到小的顺序是__________。(用序号表示)
(3)室温时,pH=3 的 NH4Cl 溶液中:c(C1ˉ)-c(NH4+) =_________mol·L-1 (填数值)
(4)NH4Al(SO4)2可作净水剂,其理由是___________________________________用必要的化学用语和相关文字说明)
(5)将浓度均为 0.1 mol·L﹣1 的③和④溶液混合,关于所得溶液下列说法错误的是_____
A.若溶液显酸性,则 c(C1ˉ)>c(NH4+ )>c(H+ )>c(OH- )
B.若 c(C1ˉ)=c(NH4+),则溶液显中性
C.若③和④等体积混合,则所得溶液满足关系:c(NH4+)+c(NH3H2O)=0.2mol·L-1
D.其浓度大小不可能为:c(C1ˉ)>c(NH4+)>c(OHˉ)>c(H+)
(6)已知 CH3COONH4 溶液为中性,试推断(NH4)2CO3 溶液的 pH________7 (填“<”“>”“=”)。
【答案】 NH4HSO4 =NH4++H++SO42- ②⑤④ 10-3 Al3+水解,Al3++3H2O![]() Al(OH)3(胶体)+ 3H+,生成的Al(OH)3 胶体吸附悬浮 颗粒使其沉降从而净化水 C >
Al(OH)3(胶体)+ 3H+,生成的Al(OH)3 胶体吸附悬浮 颗粒使其沉降从而净化水 C >
【解析】(1)NH4HSO4 为强酸的酸式盐,电离产生铵根离子、氢离子和硫酸根离子,电离方程式为NH4HSO4 =NH4++H++SO42-;(2)②NH4HSO4中氢离子会抑制铵根离子的水解,④NH3H2O属于弱碱,电离出的铵根离子浓度最小,⑤CH3COONH4中醋酸根离子会促进铵根离子的水解,故这三种溶液中铵根浓度由大到小的顺序是②⑤④;(3)室温时,pH=3 的 NH4Cl 溶液中:c(H+)=10-3mol/L,c(OHˉ)=10-11mol/L,根据电荷守恒有c(NH4+ )+c(H+ )= c(C1ˉ)+c(OH- ),故c(C1ˉ)-c(NH4+) =c(H+ )- c(OH- )= 10-3mol/L-10-11mol/L ![]() 10-3mol/L;(4)NH4Al(SO4)2可作净水剂,其理由是Al3+水解,Al3+ + 3H2O
10-3mol/L;(4)NH4Al(SO4)2可作净水剂,其理由是Al3+水解,Al3+ + 3H2O![]() Al(OH)3(胶体)+ 3H+,生成的 Al(OH)3 胶体吸附悬浮 颗粒使其沉降从而净化水;(5)A、铵根离子水解显酸性;溶液中的离子浓度为:c(C1ˉ)>c(NH4+ )>c(H+ )>c(OH- ),选项A正确;B.根据电荷守恒有c(NH4+ )+c(H+ )= c(C1ˉ)+c(OH- ),若 c(C1ˉ)=c(NH4+),则c(H+ )= c(OH- ),溶液显中性,选项B正确;C.若③和④等体积混合,则所得溶液满足关系:c(NH4+)+c(NH3H2O)=0.1mol·L-1, 选项C错误;D.其浓度大小不可能为:c(C1ˉ)>c(NH4+)>c(OHˉ)>c(H+),溶液电中性,故不可能c(NH4+ )+c(H+ )< c(C1ˉ)+c(OH- ),选项D正确。答案选C;(6)已知 CH3COONH4 溶液为中性,而醋酸的酸性强于碳酸酸,故碳酸根离子水解程度大于醋酸根离子,也大于铵根离子,故(NH4)2CO3 溶液的 pH>7。
Al(OH)3(胶体)+ 3H+,生成的 Al(OH)3 胶体吸附悬浮 颗粒使其沉降从而净化水;(5)A、铵根离子水解显酸性;溶液中的离子浓度为:c(C1ˉ)>c(NH4+ )>c(H+ )>c(OH- ),选项A正确;B.根据电荷守恒有c(NH4+ )+c(H+ )= c(C1ˉ)+c(OH- ),若 c(C1ˉ)=c(NH4+),则c(H+ )= c(OH- ),溶液显中性,选项B正确;C.若③和④等体积混合,则所得溶液满足关系:c(NH4+)+c(NH3H2O)=0.1mol·L-1, 选项C错误;D.其浓度大小不可能为:c(C1ˉ)>c(NH4+)>c(OHˉ)>c(H+),溶液电中性,故不可能c(NH4+ )+c(H+ )< c(C1ˉ)+c(OH- ),选项D正确。答案选C;(6)已知 CH3COONH4 溶液为中性,而醋酸的酸性强于碳酸酸,故碳酸根离子水解程度大于醋酸根离子,也大于铵根离子,故(NH4)2CO3 溶液的 pH>7。


科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的离子方程式为_______________________。
(2)Ca(OH)2的电离方程式为_______________。
(3)现有下列物质:①干冰②NaHCO3晶体③氨水④纯醋酸⑤FeCl3溶液⑥铜⑦蔗糖⑧熔化的NaCl,其中属于非电解质的是___________(填序号,下同),属于强电解质的有____________,属于弱电解质的有________________,能导电的物质有________________。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀H2SO4至恰好完全反应。在此实验过程中,此实验中观察到的现象有___________________________________________。
(5)下列说法正确的是_________________。
①碱性氧化物一定是金属氧化物;
②酸性氧化物一定是非金属氧化物;
③乳浊液静止后分层;
④Mg2+、SO42-、Fe3+、X四种离子以物质的量之比1:2:1:1大量共存于同一水溶液中,X可能是NO3﹣;
⑤碳酸钙是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为___________;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是_____________________________________________。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都分别能与D形成中心原子杂化方式均为___________的共价化合物X、Y、Z。其中,属于不等性杂化的是___________ (写化学式)。
(3)比较Y、Z的熔沸点Y______Z(填“>”、“<”或“=”),并解释理由_____________________。
(4)D元素能与Cu形成棕黄色固体,加水溶解并稀释过程中,溶液颜色由绿色逐渐转化为蓝色,显绿色离子是_________________,显蓝色离子中的配位原子________________。
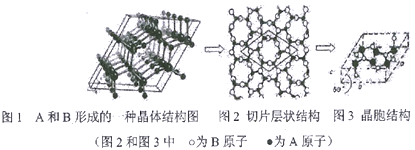
(5)A和B能形成多种结构的晶体。其中一种类似石墨的结构,其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为__________。实验测得此晶体结构属于六方晶系,晶胞结构见图3。已知图示原子都包含在晶胞内,晶胞参数a=0.64nm,c=0.24nm。其晶体密度为__________g/cm3(已知:2=1.414,后=1.732,结果精确到小数点后第2位。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含离子键的化合物是离子化合物,含共价键的化合物是共价化合物
B.离子键的形成过程中一定有电子得失
C.第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键
D.离子键与共价键的本质都是静电作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图:
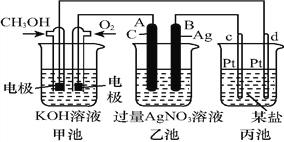
请回答:
(1)图中甲池是______装置,其中OH-移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH电极的电极反应式:_______________________________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为_____极(填“A”或“B”),
并写出此电极的电极反应式:______________________。
(4)乙池中反应的离子方程式为________________________。
(5)当乙池中B(Ag)极质量增加5.40 g时,乙池c(H+)是_______(若乙池中溶液为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是_________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.1 mol·L-1 CH3COONa溶液的pH大于7
C. CH3COOH溶液与Na2CO3反应生成CO2
D. 0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。已知碱石灰的成分是氢氧化钠和氧化钙的混合物;炭与水蒸气在高温条件下发生以下反应:C + H2O(g)![]() CO + H2。回答下列问题:
CO + H2。回答下列问题:
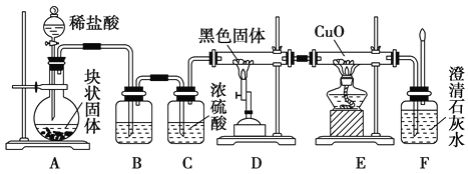
(1)写出装置A中发生反应的离子方程式____________________。
(2)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:____________。
(3)装置D中黑色固体为___________ (填名称)。
(4)按照如图装置进行实验时,首先进行的操作是___________________________________ 。
(5)根据实验中的____________________________现象,可证明CO具有还原性。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置____与____之间连接下图中的____________________装置(填序号)。
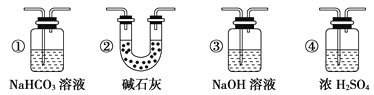
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增大C,B的平衡转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com