
【题目】研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2 . 他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)( )
A.0.448L
B.2.240L
C.2.016L
D.无法确定
【答案】C
【解析】解:
根据氧化还原反应的得失电子守恒规律,KMnO4中Mn得到的电子总数,等于KMnO4中O失去的电子总数与浓盐酸中氯离子失去电子变为氯气失去的电子总数之和.6.32gKMnO4的物质的量n= ![]() ═
═ ![]() =0.04mol,0.112LO2的物质的量=
=0.04mol,0.112LO2的物质的量= ![]() =
= ![]() =0.005mol
=0.005mol
得到的电子:KMnO4~5e﹣~Mn2+ , K2MnO4~4e﹣~Mn2+ , MnO2~2e﹣~Mn2+ ,
失去的电子:2Cl﹣~2e﹣~Cl2 , 2O~4e﹣~O2 ,
根据电子守恒计算:
n(KMnO4)×5e﹣=n(O2)×4e﹣+n(Cl2)×2e﹣
0.04mol×5e﹣=0.005mol×4e﹣+n(Cl2)×2e﹣
n(Cl2)=0.09mol
所以生成的氯气标准状况下的体积V(Cl2)=n×Vm=0.09mol×22.4L/mol=2.016L.
故选C.
【考点精析】掌握氯气的实验室制法是解答本题的根本,需要知道实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】在水中,水分子可彼此通过氢键形成(H2O)n的小集团。在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体。(H2O)n的n=5时,下列说法中正确的是 ( )
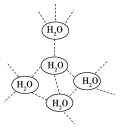
A.(H2O)n是一种新的水分子
B.(H2O)n仍保留着水的化学性质
C.1 mol(H2O)n中有2个氢键
D.1 mol(H2O)n中有4 mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
(1)HA的电离平衡常数K=_____________。
(2)升高温度时,K将_____________(填“增大”、“减小”或“不变”)。(3)由HA电离出的c(H+)约为水电离出的c(H+)的_____________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2 , 该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式
(2)该反应的正反应是反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL﹣1) | 0.54 | 0.68 | 0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中点.比较图中B、D两点所对应的正反应速率BD(填“>”、“<”或“=”).理由是 . 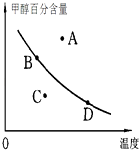
(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定)有剩余气体。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是( )
①粉末中一定有Na2O、Na2O2、NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质的焰色反应都显黄色,A、B与水反应都有气体放出,A与水的反应放出的气体具有还原性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能变成D。
(1)写出A~E的化学式: A_________、B__________、C_________、D__________、E_________。
(2)E加热生成D的化学方程式是:___________________________。
(3)C溶液和CO2反应生成D的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx都是大气污染物.
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是
(2)采取还原法,用炭粉可将氮氧化物还原.
已知:N2(g)+O2(g)═2NO(g)△H=+180.6kJmol﹣1;C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
则反应C(s)+2NO(g)═CO2(g)+N2(g)△H=kJmol﹣1 .
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为(填写“氧化剂”或“还原剂”).下式中X必须为无污染的物质,系数n可以为0;NO2+G ![]() N2+H2O+nX (未配平的反应式);
N2+H2O+nX (未配平的反应式);
下列化合物中,满足上述反应式中的G是(填写字母);
a.NH3b.CO2c.SO2d.CH3CH2OH
(4)利用氨水可以将SO2和NO2吸收,原理如图1所示:NO2被吸收的离子方程式是 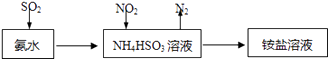
(5)利用图2所示装置(电极均为惰性电极)也可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 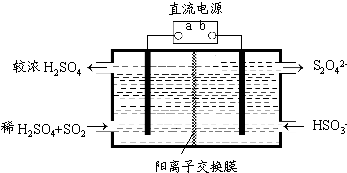
①b极的电极反应式为;
②在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO32﹣生成.该反应离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com