
已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
Fe2O3(s)+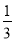 CO(g)=
CO(g)=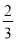 Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4 kJ·mol-1
则14g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为
A.-218 kJ·mol-1 B.-109 kJ·mol-1
C.+218 kJ·mol-1 D.+109 kJ·mol-1
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:2017届贵州省高三上模拟四化学卷(解析版) 题型:填空题
甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)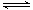 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)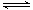 CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为______________热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从表中选择)。
(2) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3 kJ/mol
则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72?)时,实验室利用下图装置模拟该法:
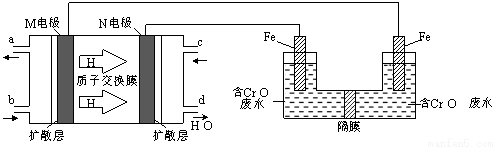
① N电极的电极反应式为 。
② 请完成电解池中Cr2O72?转化为Cr3+的离子反应方程式:
Cr2O7 2?+ Fe2+ + [ ] ═ Cr3++ Fe3++ [ ]
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5 mol•L﹣1 时,Cr3+沉淀完全,此时溶液的pH= 。 (已知, Ksp[Cr(OH)3]=6.4×10?31,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F、S-F键需吸 收的能量分别为160kJ、330kJ,则S(s)+3F2(g)=SF6(g)的反应热ΔH为
收的能量分别为160kJ、330kJ,则S(s)+3F2(g)=SF6(g)的反应热ΔH为
A.-1780kJ/mol B.-1220kJ/mol C.-450kJ/mol D.+430kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:填空题
Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-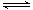 H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A.0.1 mol/L的盐酸和0.1 mol/L的氢氧化钠溶液
B.0.1 mol/L的硫酸和0.1 mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的醋酸溶液和pH=10的氨水溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
下列水溶液一定呈中性的是
A.c(NH4+)=c(C1-)的NH4Cl 溶液
B.c(H+)=1×10-7mol·L-1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH= 11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高二11月月考化学试卷(解析版) 题型:选择题
对于反应mA+nB==pC,下列说法正确的是( )
A.某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的
B.其他条件不变,增大压强,反应速率加快
C.若增加或减小B的物质的量,则反应速率一定会发生明显的变化
D.其他条件不变,升高温度,反应速率加快
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一期中化学卷(解析版) 题型:填空题
一定条件下,NO跟NH3可以发生反应生成N2和H2O,6NO+4NH3=5N2+6H2O,现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)在方程式中标出电子转移的方向和数目。6NO+4NH3=5N2+6H2O;
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量的比为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
用0.1000mol·L-1NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗
B.酸式滴定管在使用前未用待测液盐酸润洗
C.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
D.滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com