
| A. | 油脂属于酯类 | B. | 蛋白质水解的最终产物是氨基酸 | ||
| C. | 淀粉完全水解的产物是葡萄糖 | D. | 纤维素不能发生水解反应 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3═K++Cl-+3O2- | B. | H2SO4═2H++SO42- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | Na2SO4═2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p/400 mol•L-1 | B. | 20 p mol•L-1 | C. | 1.25 p mol•L-1 | D. | 2.5 p mol••L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| C. | 2NO2=O2+2NO△H=+116.2kJ/mol(反应热) | |
| D. | S(s)+O2(g)═SO2(g)△H=-296.8kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
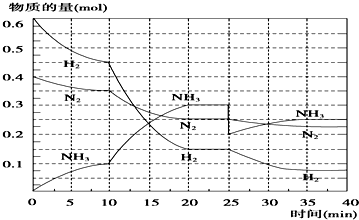
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 催化剂对反应的影响 | 平衡体系增加N2对反应的影响 |
| 图示 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,写出实验室制取该氢化物的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O.
,写出实验室制取该氢化物的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com