
向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述中正确的是( )
A.钠块开始反应时,浮在乙醇液面的上面
B.钠块熔化成小球
C.钠块与乙醇的反应比钠块与水的反应剧烈
D.钠块表面有气体放出
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、0.1 mol/L向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )
A.0.15 mol/L B.0.225 mol/L
C.0.30mol/L D.0.45 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_____________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点-33 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下图(热源及夹持装置略去)
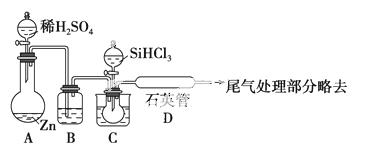
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________________________。
装置D中发生反应的化学方程式为_____________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是(填写字母代号)________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示的装置进行实验:

(1)实验开始一段时间后,可观察到锥形瓶瓶口上方有白烟生成,请补充可能观察到的其他现象:______________________________________________;
有关化学方程式为__________________________________________________。
(2)由于气温的原因,上述实验一段时间后现象不太明显,需要向锥形瓶内加入下列哪种物质才能重新看到明显的现象?________。
A.NaOH B.CaO
C.浓H2SO4 D.NH4Cl
(3)经过对比实验证明,在其他条件相同时,用空气代替氧气的实验效果较差,主要原因是________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,某同学做乙醇氧化实验时将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰的a、b两点时现象明显不同,请写出a、b两点的实验现象,并解释产生该现象的原因。

| 实验现象 | 原因 | |
| a | ||
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应,符合该图的是( )

A.Ba(OH)2溶液中滴加与其浓度相同的H2SO4溶液
B.NaOH溶液中滴加与其浓度相同的稀盐酸
C.CH3COOH溶液中滴加与其浓度相同的KOH溶液
D.氨水中滴加与其浓度相同的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反
应制备:FeSO4+Na2CO3=== FeCO3↓+Na2SO4 FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O 下表列出了相关金
属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Al3+ | 3. 0 | 5. 0 |
| Fe2+ | 5. 8 | 8. 8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
 (3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚 铁晶体。分离过程中加入无水乙醇的目的是
。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先 制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4 溶液, ,得到FeSO4·7H2O 晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com