
分析 (1)滴定终点时,溶液由无色变为高锰酸根离子颜色且30s内不变色;
(2)盐酸溶液中氯离子被高锰酸钾溶液氧化;
(3)不加稀硫酸酸化,MnO4-被还原为MnO2,双氧水被氧化生成氧气,根据电荷守恒可知有氢氧根离子生成,再根据原子守恒判断是否有水生成,配平书写;
(4)生成的白色固体0.5825g为硫酸钡,根据n=$\frac{m}{M}$计算硫酸钡的物质的量,根据硫酸根守恒可知n(Na2SO4)=n(BaSO4).根据方程式计算25mL溶液中n(H2O2),再根据m=nM计算25mL溶液中硫酸钠、过氧化氢的质量,继而计算结晶水的质量,根据各物质的物质的量之比确定x:y:z,据此书写化学式.
解答 解:(1)滴定终点时,溶液由无色变为高锰酸根离子颜色紫红色且半分钟内不变色,
故答案为:溶液由无色变成紫红色且半分钟内不变色;
(2)步骤②中使用盐酸酸化,而步骤③中改用硫酸酸化的原因是氯离子易被高锰酸钾氧化,
故答案为:氯离子易被高锰酸钾氧化;
(3)不加稀硫酸酸化,MnO4-被还原为MnO2,Mn元素共降低3价,双氧水被氧化生成氧气,氧元素共升高2价,化合价最小公倍数为6,故MnO4-的系数为2、MnO2的系数为2,H2O2的系数为3、O2系数为3,根据电荷守恒可知有OH-生成,其系数为2,由原子守恒可知,有水生成,其系数为2,反应离子方程式为:2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O,
故答案为:2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O;
(4)n(Na2SO4)=n(BaSO4)=$\frac{0.5825g}{233g/mol}$=2.50×10-3mol,
根据2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑可知,
n(H2O2)=$\frac{5}{2}$×0.02000mol•L-1×0.025L/=1.25×10-3mol
m(Na2SO4)=142g•mol-1×2.50×10-3mol=0.355g
m(H2O2)=34g•mol-1×1.25×10-3mol=0.0425g
n(H2O)=(1.7700g×$\frac{25ml}{100ml}$-0.355g-0.0425g)÷18g•mol-1=2.50×10-3mol
x:y:z=n(Na2SO4):n(H2O2):n(H2O)=2:1:2
硫酸钠-过氧化氢加合物的化学式为2Na2SO4•H2O2•2H2O
答:硫酸钠-过氧化氢加合物的化学式为2Na2SO4•H2O2•2H2O.
点评 本题属于物质组成分析与化学综合计算题,涉及氧化还原反应滴定、离子方程式书写等,题目难度中等,注意运用元素守恒进行推理计算,学习中紧紧抓住元素守恒守恒、质量守恒、电荷守恒、极端分析等化学常用分析方法.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
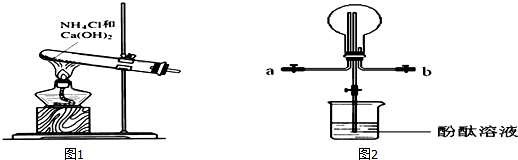
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
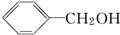 ,B为
,B为 (均填结构简式),A、B互为同分异构体;
(均填结构简式),A、B互为同分异构体;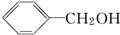 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2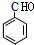 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
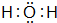 、
、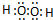 ,D、E形成的化合物
,D、E形成的化合物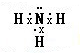 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在烧瓶中装约$\frac{1}{3}$体积的自来水,并放入几粒沸石防暴沸 | |
| B. | 若使用温度计须将温度计水银球插到自来水中 | |
| C. | 冷水从冷凝管下口入,上口出 | |
| D. | 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、OH-、NO3- | B. | Cu2+、Ba2+、Cl-、NO3- | ||
| C. | Na+、Mg2+、OH-、SO42- | D. | Fe2+、H+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4、NaOH-腐蚀品 | B. | 酒精-易燃气体 | ||
| C. | KMnO4-氧化剂 | D. | 白磷-易燃固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com