
【题目】如表是几种常见弱酸的电离平衡常数(25℃)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 | K1=4.4×10-7 |
HCO | K2=4.7×10-11 | |
H2S | H2S | K1=1.3×10-7 |
HS- | K2=7.1×10-15 | |
H3PO4 | H3PO4 | K1=7.1×10-3 |
H2PO4- | K2=6.3×10-8 | |
HPO42- | K3=4.2×10-13 |
(1) 当温度升高时,K值_____(填“增大”“减小”或“不变”)。
(2) 若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是_____,最弱的是_____。由离子反应规律及上述数据判断,下列各组物质在溶液中混合后能发生反应的有_____(填字母)。
a. CH3COOH+NaH2PO4
b. H2S+Na2CO3
c. CO2+Na2HPO4
(3) 分析多元弱酸各步电离的K值大小,你认为一定浓度的某多元弱酸溶液中,c(H+)的大小主要由_______决定。假设某氢硫酸溶液的浓度为0.001 3 mol·L-1,则溶液中c(H+)=______。
(4) 请设计一种方案,能通过直观的实验现象判断醋酸的酸性强于碳酸,该方案所用试剂是____,反应的化学方程式为_____。
【答案】增大 H3PO4 HS- bc 第一步电离程度大小 1.3×10-5 mol·L-1 醋酸、Na2CO3 Na2CO3+2CH3COOH==CO2↑+H2O+2CH3COONa
【解析】
(1)弱电解质的电离为吸热过程,升高温度促进电离;
(2)酸的电离平衡常数越大,其酸性越强,则酸性最强的其电离平衡常数最大,酸性最弱的电离平衡常数越小;
酸性强的酸制取酸性较弱的酸;
(3)分析多元弱酸各步电离的K值大小,一定浓度的某多元弱酸溶液中,c(H+)的大小主要由第一步电离程度大小决定;
按H2S的第一步电离常数计算;
(4)利用CH3COOH的酸性强于碳酸,能发生反应:Na2CO3+2CH3COOH=CO2↑+H2O+2CH3COONa,且现象比较明显设计实验。
(1)弱电解质的电离为吸热过程,升高温度促进电离,所以升高温度,电离平衡常数K会增大;
(2)酸的电离平衡常数越大,其酸性越强,根据电离平衡常数知,酸性最强的是H3PO4,最弱的是HS-;
酸性强的酸制取酸性较弱的酸,a. 酸性:CH3COOH小于H3PO4 ,CH3COOH+NaH2PO4不能反应,故a不选;
b.H2S酸性大于HCO3- ,H2S+Na2CO3能反应,故b选;
c.碳酸的酸性强于 H2PO4-,CO2+Na2HPO4能反应,故c选;
故选bc;
(3)分析多元弱酸各步电离的K值大小,一定浓度的某多元弱酸溶液中,c(H+)的大小主要由第一步电离程度大小决定;
按H2S的第一步电离常数计算;H2S![]() H++HS-,K1=1.3×10-7=c(H+)·c(HS-)/cH2S),c(H+)=
H++HS-,K1=1.3×10-7=c(H+)·c(HS-)/cH2S),c(H+)=![]() =1.3×10-5 mol·L-1;
=1.3×10-5 mol·L-1;
(4) 利用CH3COOH的酸性强于碳酸,能发生反应:Na2CO3+2CH3COOH==CO2↑+H2O+2CH3COONa,设计实验,所用试剂是醋酸、Na2CO3。


科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量的FeSO4、H2SO4和少量的Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁的工艺流程如图所示:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiO2+水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
回答下列问题:
(1)TiOSO4中钛元素的化合价是____________,步骤①中分离硫酸亚铁溶液和滤渣的操作是___________。
(2)滤渣的主要成分为TiO2·xH2O,结合离子方程式解释得到滤渣的原因:________。
(3)从硫酸亚铁溶液中得到硫酸亚铁晶体的操作方法是____________________;硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应的氧化剂和还原剂的物质的量之比为______。
(4)步骤④中发生反应的离子方程式为______________________。
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及____________________。
(6)实验室中检验溶液B中主要阳离子的方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的价电子排布式为___。
(2)磷的一种同素异形体——白磷(P4)的空间构型为___,其键角为__,推测其在CS2中的溶解度___(填“大于”或“小于”)在水中的溶解度。
(3)膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试用价层电子对互斥理论分析PH3的键角小于NH3的原因:___。
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A、B的化学式分别为___、__,A的中心原子杂化轨道类型为___。
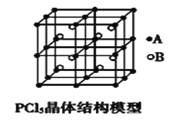
(5)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素是__(填元素符号)。
(6)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如下表所示。试从结构的角度分析它们熔点不同的原因:__。
物质 | BN | AlN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
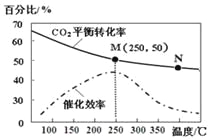
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
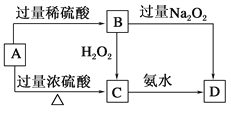
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在1L 0.1mol·L-1NH4Cl溶液中,
(1)水解的离子反应方程式________
(2)溶液中存在的微粒种类:H2O、________
(3)溶液中各种离子浓度从大到小的顺序为:________
(4)溶液中存在的电荷守恒等式 ________
(5)溶液中存在的物料守恒等式 ________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g)2NH3(g)+Q的模拟研究,在1L密闭容器中,分别加入0.1molN2和0.3molH2。实验①、②、③中c(N2)随时间(t)的变化如图所示,实验②从开始到达平衡状态的过程中,用H2表示的平均反应速率为____。与实验①相比,实验②所采用的实验条件可能为____(填字母)
a.增大压强 b.减小压强 c.升高温度 d.降低温度 e.使用催化剂

(2)NH3用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g)2N2(g)+3H2O(g)+Q,欲提高废气中氮氧化物的转化率,可采取的措施是____(填字母);
a.升高温度 b.增大压强 c.增大NH3的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com