
分析 (1)胶体分散质的直径大小范围是1~100 nm;
(2)FeCl3的水溶液滴入沸水可得到以Fe(OH)3胶体;
(3)此分散系为胶体,具有胶体的性质.
解答 解:(1)FeCl3的水溶液滴入沸水可得到以Fe(OH)3胶体,胶体分散质的直径大小范围是1~100 nm,故答案为:1~100 nm;
(2)FeCl3的水溶液滴入沸水可得到以Fe(OH)3胶体,生成Fe(OH)3胶体的离子方程式是:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;
(3)到Fe(OH)3胶体,具有丁达尔效应、电泳、聚沉等性质,溶液中溶质粒子能通过半透膜,胶体中的分散质粒子不能通过,加入硝酸银电解质后胶体发生聚沉现象,故答案为:c.
点评 本题考查胶体的制备、性质等,难度不大,注意离子方程式的书写,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g CO和22.4 L CO2中含有的碳原子数一定相等 | |
| B. | n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L M气体分子的质量为16 g,则M气体的摩尔质量是32 | |
| D. | 现有CO、CO2、O3三种气体,它们均含有1 mol O,则三种气体的物质的量之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙酸与氢氧化钠溶液共热:BrCH2COOH+OH-$\stackrel{△}{→}$BrCH2COO-+H2O | |
| B. | 配置银氨溶液:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| C. | 向新制Cu(OH)2中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: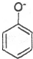 +CO2+H2O→ +CO2+H2O→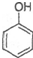 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
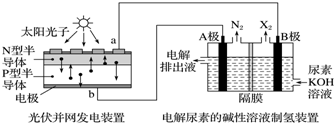
| A. | 工作时,A极的电极上CO(NH2)2放电生成N2反应为还原反应 | |
| B. | 工作时,B极的电极反应式为2H2O+2e-═2OH-+H2↑ | |
| C. | N型半导体为正极,P型半导体为负极 | |
| D. | 制氢装置溶液中电子流向:从B极流向A极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com