
分析 在一定温度和压强下,某固定容积的密闭容器中氮气和氢气反应生成氨气,一定条件下经过2min达到平衡,生成0.2mol/L NH3,结合化学平衡三段式列式计算
N2 +3H2=2NH3
起始量(mol/L) 0.16 0.4 0
变化量(mol/L) 0.1 0.3 0.2
平衡量(mol/L) 0.06 0.1 0.2
(1)反应速率V=$\frac{△c}{△t}$;
(2)转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:在一定温度和压强下,某固定容积的密闭容器中氮气和氢气反应生成氨气,一定条件下经过2min达到平衡,生成0.2mol/L NH3,
N2 +3H2=2NH3
起始量(mol/L) 0.16 0.4 0
变化量(mol/L) 0.1 0.3 0.2
平衡量(mol/L) 0.06 0.1 0.2
(1)反应速率V(H2)=$\frac{△c}{△t}$=$\frac{0.3mol/L}{2min}$=0.15mol/(L•min),
答:用H2表示的速率是0.15mol/(L•min);
(2)N2转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.1mol/L}{0.16mol/L}$×100%=62.5%,
答:N2的转化率是62.5%.
点评 本题考查了化学平衡三段式计算方法,反应速率、转化率概念的计算分析,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
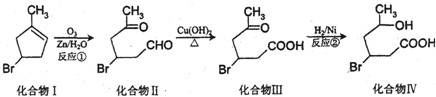
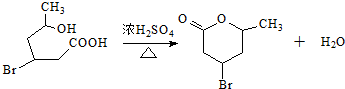 .
.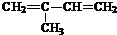 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为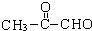 、HCHO.
、HCHO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
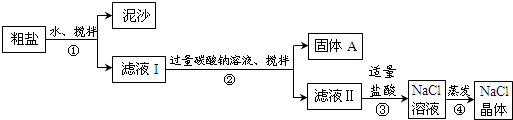
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ①有气泡冒出且澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入②稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ③猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, ④加入硝酸酸化的硝酸钡溶液 | ⑤产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>Na2O>N2>O2 | D. | 金刚石>生铁>纯铁>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在氧气中燃烧 | B. | 铁粉与高温水蒸气反应 | ||
| C. | 碳酸氢铵受热分解 | D. | Na2O2加入氯化铵溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
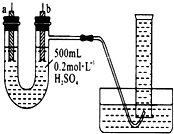 给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com