
【题目】为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
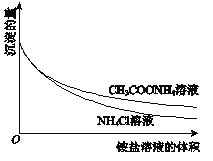
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是
A. Mg(OH)2浊液中存在:Mg(OH)2(s)![]() Mg2+(aq)+2OH﹣(aq)
Mg2+(aq)+2OH﹣(aq)
B. ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3H2O
C. H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D. ③中获得的图象与②相同
【答案】D
【解析】
A.Mg(OH)2浊液中,Mg(OH)2为难溶电解质,存在沉淀溶解平衡,则浊液中存在:Mg(OH)2(s)![]() Mg2+(aq)+2OH﹣(aq),A正确;
Mg2+(aq)+2OH﹣(aq),A正确;
B.根据图象,加入NH4Cl或CH3COONH4,Mg(OH)2质量减少,说明Mg(OH)2溶于铵盐溶液,发生反应:Mg(OH)2+2NH4+=Mg2++2NH3H2O,B正确;
C.NH4Cl溶液为酸性溶液,NH4+发生水解产生H+,相当于发生酸碱反应,则H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程,C正确;
D.③中将①中的NaOH溶液用氨水替换,重复上述实验,NaOH是强碱,抑制Mg(OH)2的溶解,所得的图象与②不相同,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】超顺磁性的Fe3O4粒子(粒子平均直径为25nm)在医疗上有重要作用,实验室制备方法如下:在有N2保护和剧烈搅拌条件下,向FeCl3、FeCl2混合溶液中滴加氨水,可得到黑色的Fe3O4。实验装置如图:
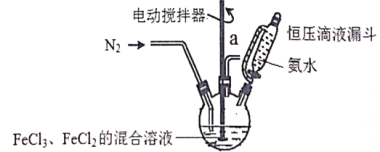
请回答下列问题:
(1)恒压滴液漏斗的优点是______________________。
(2)充N2的目的是___________,反应温度应控制在50℃,加热方法为___________。
(3)制备超顺磁性Fe3O4粒子反应原理的离子方程式为______________________。
(4)充分反应后,将三颈烧瓶中的混合物通过离心分离,然后水洗,最后用无水乙醇洗涤,用无水乙醇洗涤的优点是___________;为了验证得到的固体是超顺磁性的Fe3O4粒子,实验操作:_______________。为了检验超顺磁性粒子中含有+2价的铁,需要的化学试剂为___________(填代号)。
A.KSCN溶液 B.HCl溶液 C.H2O2溶液 D.K3[Fe(CN)6]溶液
(5)实验制得的超顺磁性的Fe3O4粒子中含有少量的Fe(OH)3,为测得Fe3O4的含量,称取mg试样,放在小烧杯中用足量稀硫酸溶解后定容于100mL容量瓶中,准确量取其中的20.00mL溶液置于锥形瓶中,然后用cmol/L的KMnO4溶液进行滴定,当______________________停止滴定,然后重复二次滴定,平均消耗KMnO4溶液ⅴmL,该样品的纯度为___________。(已知MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热值是指一定条件下单位质量的物质完全燃烧所放出的热量。已知H2(g)、CO(g)和CH3OH(l)的热值分别为143 kJ· g-1、10 kJ·g-1和23 kJ·g-1。请回答下列问题:
(1)写出CO燃烧反应的热化学方程式为__________________________________________。
(2)表示甲醇燃烧热的热化学方程式为__________________________________________。
(3)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为__________________________。
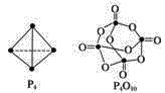
(4)白磷与氧可发生如下反应:P4(g)+5O2(g)![]() P4O10(g)。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol根据图示的分子结构和有关数据计算该反应的反应热_____________。
P4O10(g)。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol根据图示的分子结构和有关数据计算该反应的反应热_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应:①M(s)+N(g) R(g) ΔH= - Q1 kJ/mol
②2 R(g)+N(g) 2T(g) ΔH= - Q2 kJ/mol(已知Q1、Q2、Q3均为正值)
下列说法正确的是
A. 1molR(g)的能量总和大于1molM(s)与1molN(g)的能量总和
B. 将2mol R(g)与1molN(g)充分混合,在一定条件下充分反应,放出热量Q2 kJ
C. 当1molM(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+0.5Q2)kJ
D. M(g)+N(g) R(g) ΔH= - Q3 kJ/mol,则Q3 < Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下(T1 <T2),可逆反应2X(g) ![]() 2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(
2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(1)PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子(OH-忽略不计)的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度(mol/L) | 2.0×10-6 | 2.8×10-5 | 3.5×10-5 | 6.0×10-5 |
则试样的pH为________________________。
(2)一定条件下,以CO和H2合成清洁能源CH3OH,其热化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:

①该可逆反应的ΔH__________0(填“>”“<”或“=”)。A、B、C三点对应的平衡常数KA、KB、KC的大小关系是______________。压强:p1__________p2(填“>”“<”或“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v(正)___________v(逆)(填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_________(填字母)。
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2 mol CO和4 mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2 L,则在该条件下反应的平衡常数K为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为__________ mol,其中CO2为__________mol,CO占总体积的__________,混合气体的摩尔质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(NO2)2(亚硝酸钙)是易溶于水的无色晶体,可用作混凝土中钢筋的防护剂。
(1)Ca(NO2)2的制备方法很多。
①实验室可用反应Ca(NO3)2+2CaFe2O4+4NO![]() 3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
②用石灰乳吸收硝酸工业尾气中氮氧化物制备Ca(NO2)2,其中NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2的化学方程式为_____,经过滤得到含Ca(NO2)2的溶液为液态产品。
(2)测定某液态产品中NO3-含量的步骤如下:
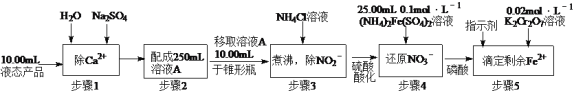
已知:步骤4中的反应为NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O,
步骤5中的反应为6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O。
若步骤5滴定至终点时消耗K2Cr2O7溶液20.00mL,计算液态产品中NO3-的含量(单位g·L-1,最后结果保留一位小数,写出计算过程)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com