
| A. | Na2O2属于危险化学品,其标识应为: | |
| B. | 当你走进化学实验室之前,应认真阅读实验室的安全守则 | |
| C. | 中国大陆的火警报警电话为“119”,香港、澳门为“999” | |
| D. | 一般情况下,金属类物质着火时不宜使用二氧化碳类灭火器 |
分析 A.Na2O2有强氧化性;
B.仔细阅读并自觉遵守有关实验室规则是保证实验成功和实验安全的重要手段;
C.香港、澳门为“999”;
D.活泼金属能与二氧化碳反应.
解答 解:A.Na2O2有强氧化性,为氧化剂,不易燃,故A错误;
B.走进化学实验室,仔细阅读并自觉遵守有关实验室规则是保证实验成功和实验安全的重要手段,故B正确;
C.大陆的火警报警电话为“119”,香港、澳门为“999”,故C正确;
D.活泼金属能与二氧化碳反应,如钠、镁等,故D正确.
故选A.
点评 本题考查化学实验安全及事故处理,题目难度不大,注意掌握化学实验基本操作方法,明确处理突发事故的方法,确保人身安全、降低国家财产损失.


科目:高中化学 来源: 题型:解答题
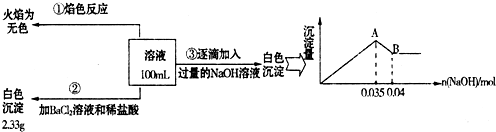
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
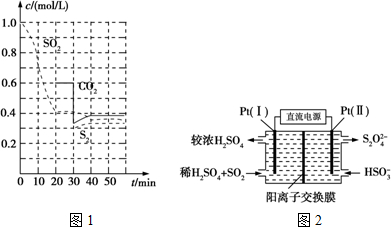
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左盘下沉 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:A>B | B. | B与C不能存在于同一离子化合物中 | ||
| C. | 氧化物的水化物的酸性:C<D | D. | 阴离子的半径:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L的NaOH溶液中加入等体积的0.1mol/L的HCl溶液 | |
| B. | 向0.1mol/L的NaOH溶液中加入等体积的0.1mol/L的CH3COOH溶液 | |
| C. | 向0.1mol/L的Ba(OH)2溶液中加入等体积的0.1mol/L的H2SO4溶液 | |
| D. | 向0.1mol/L的NH3•H2O溶液中加入等体积的0.1mol/L的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
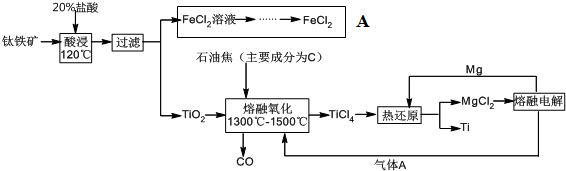
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2SO4溶于水中,所得溶液中Na+个数为NA | |
| B. | 18g水含有电子数为8NA | |
| C. | 1L 0.3mol•L-1Na2SO4溶液中,含有Na+和SO42-总数为0.9NA | |
| D. | 1个氢气分子(H2)的质量为2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com