
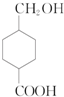
 .M的同分异构体有多种,符合下列条件的同分异构体有( )
.M的同分异构体有多种,符合下列条件的同分异构体有( )| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
分析 M的官能团有羟基和羧基,依题意要求六元环上有3个取代基,且官能团不变,则三个取代基是甲基、羟基和羧基.又要求同一个碳原子上不能连接两个取代基.可按下列思路分析:先写两个取代基的同分异构体,然后再用羧基取代环上一个氢原子.
解答 解:M的官能团有羟基和羧基,依题意要求六元环上有3个取代基,且官能团不变,则三个取代基是甲基、羟基和羧基.又要求同一个碳原子上不能连接两个取代基.可按下列思路分析:先写两个取代基的同分异构体:如①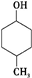 ;②
;② ;③
;③ ,然后再用羧基取代环上一个氢原子,分别得到2种、4种、4种同分异构体,符合条件的同分异构体有10种.
,然后再用羧基取代环上一个氢原子,分别得到2种、4种、4种同分异构体,符合条件的同分异构体有10种.
故选B.
点评 本题考查了同分异构体的书写方法,遵循分子式相同结构式不同的特点,按照顺序有序书写,避免漏写错写或多写,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 甲苯苯环上的一个氢原子被含 4 个碳原子的烷基取代,所得产物有12种 | |
| B. | 等物质的量的氯气与乙烷在光照条件下反应得到10种产物 | |
| C. | 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为6种 | |
| D. | 苯乙烯和氢气完全加成的产物的一溴取代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 银锌纽扣电池工作时,Ag2O被还原为Ag | |
| B. | 碱性锌锰电池中,MnO2是催化剂 | |
| C. | 放电时,铅酸蓄电池中硫酸浓度不断增大 | |
| D. | 电镀时,待镀的金属制品表面发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与氩原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与氩原子相同;R原子的d轨道上有3个空轨道.请回答下列问题: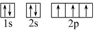 ,R基态原子的价层电子排布式为3d24s2.
,R基态原子的价层电子排布式为3d24s2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硝酸亚铁溶液中滴加少量稀硫酸:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | 把反应Cu+2FeCl3═2FeCl2+CuCl2设计成原电池,其正极反应为Fe3++e-═Fe2+ | |
| D. | 向硫酸氢钠溶液中加入氢氧化钡溶液至中性,则离子方程式为H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
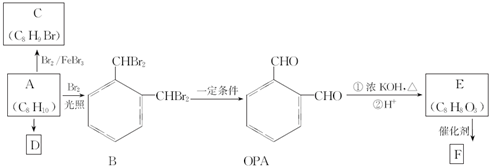
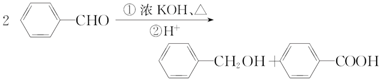
 .
. 、
、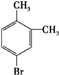 .
.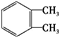 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$ $→_{△}^{CH_{3}CH_{2}OH、浓硫酸}$
$→_{△}^{CH_{3}CH_{2}OH、浓硫酸}$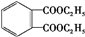 .
.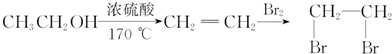
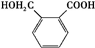 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$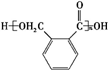 +(n-1)H2O.
+(n-1)H2O.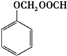 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
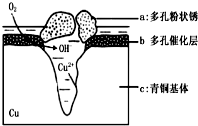 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极 b 被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145gCu 2 ( OH ) 3 Cl,则理论上消耗标准状况氧气体积为 0.448L | |
| D. | 正极的电极反应式为:正极反应是 O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由上述热化学方程式可知d>c | |
| B. | H2的燃烧热为d kJ/mol | |
| C. | CH3OH(g)═CO(g)+2H2(g)△H=(b+2c-a)kJ/mol | |
| D. | 当CO和H2的物质的量之比为1:2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为$\frac{Q}{b+2c}$mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com