
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
分析 A.根据溶度积常数计算出银离子的浓度,再比较大小;
B.根据Qc与Ksp相对大小判断;
C.溶度积小的沉淀已转化为溶解度更小的沉淀;
D.溶度积小的沉淀先生成.
解答 解:A.在Ag2C2O4饱和溶液中,Ksp(Ag2C2O4)=3.5×10-11 mol3•L-3=$\frac{1}{2}$c3(Ag+),因此c(Ag+)=$\root{3}{0.7}$×10-4mol/L,
在AgCl饱和溶液中,Ksp(AgCl)=1.8×10-10 mol2•L-2=c(Ag+)•c(Cl-)=c2(Ag+),因此c(Ag+)=$\sqrt{1.8}$×10-5mol/L,
在AgI饱和溶液中,Ksp(AgI)=1.5×10-16mol2/L-2=c(Ag+)•c(I-)=c2(Ag+),因此c(Ag+)=$\sqrt{1.5}$×10-8mol/L;
所以AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI,故A正确;
B.将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,c(Ag+)=0.01mol/L,c(SO42-)=0.01mol/L,则Qc=0.012×0.01=10-6<Ksp(Ag2SO4)=1.2×10-5,所以没有沉淀生成,故B错误;
C.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,溶度积小的沉淀已转化为溶解度更小的沉淀,所以向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,会生成AgI沉淀,故C错误;
D.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,溶度积小的沉淀先生成,所以向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先生成AgI沉淀,故D错误.
故选A.
点评 本题主要考查溶度积常数的概念和有关计算,题目难度中等,做题时注意不同物质的化学式是否相似,化学式相似的溶度积常数越小,溶液的浓度越小,侧重于考查学生的分析能力和计算能力.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 临氯甲苯、1,2-二氯乙烷、3-甲基-1-丁烯的结构简式分别为: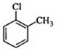 CH2Cl-CH2Cl CH2Cl-CH2Cl 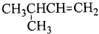 | |
| B. | 2,3,4一三甲基戊烷的核磁共振氢谱中出现五组峰 | |
| C. | 3,4一二甲基己烷的一氯代产物有4种 | |
| D. | 甲苯、硝基苯、2-甲基丙烯分子中的所有碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
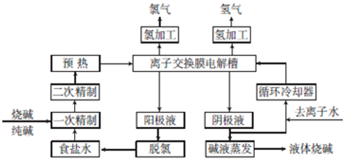
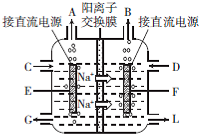
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
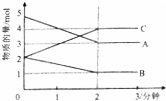 Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)
Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)  | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中0族元素的单质全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子,第一电离能越大 | |
| D. | 所有主族元素的原子形成单核离子时的价数都和它的族数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
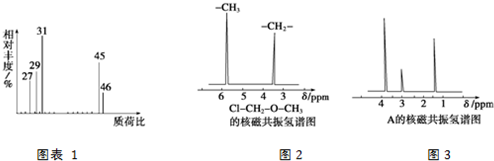
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com