
 »ÆѧŹµŃéµÄĪ¢ŠĶ»ÆæÉÓŠŠ§µŲ¼õÉŁĪŪČ¾£¬ŹµĻÖ»ÆѧŹµŃéĀĢÉ«»ÆµÄŅŖĒó£®Ä³Ń§Éś°“ĻĀĮŠ²Ł×÷×öŅ»øöŹµŃé£ŗŌŚŅ»æéĻĀ³Ä°×Ö½µÄ²£Į§Ę¬µÄ²»Ķ¬Ī»ÖĆ·Ö±šµĪ¼ÓÅضČĪŖ0.1mol/LµÄKBr”¢KI£Øŗ¬ µķ·ŪČÜŅŗ£©”¢NaOH£Øŗ¬·ÓĢŖ£©”¢FeCl2£Øŗ¬KSCN£©ČÜŅŗø÷1µĪ£¬ĆæÖÖŅŗµĪ±Ė“Ė·ÖæŖ£¬Ī§³É°ė¾¶Š”ÓŚ±ķĆęĆóµÄŌ²ŠĪ£ØČēĻĀĶ¼ĖłŹ¾£©£¬ŌŚŌ²ŠÄ“¦·ÅÖĆ2Į£Ö„ĀéĮ£“󊔵ÄKMnO4¾§Ģ壬ĻņKMnO4¾§ĢåµĪ¼ÓŅ»µĪÅØŃĪĖį£¬ŌŁĮ¢¼“½«±ķĆęĆóøĒŗĆ£®£ØŅŃÖŖ£ŗ2KMnO4+16HCl£ØÅØ£©ØT2KCl+2MnCl2+5Cl2”ü+8H2O£©
»ÆѧŹµŃéµÄĪ¢ŠĶ»ÆæÉÓŠŠ§µŲ¼õÉŁĪŪČ¾£¬ŹµĻÖ»ÆѧŹµŃéĀĢÉ«»ÆµÄŅŖĒó£®Ä³Ń§Éś°“ĻĀĮŠ²Ł×÷×öŅ»øöŹµŃé£ŗŌŚŅ»æéĻĀ³Ä°×Ö½µÄ²£Į§Ę¬µÄ²»Ķ¬Ī»ÖĆ·Ö±šµĪ¼ÓÅضČĪŖ0.1mol/LµÄKBr”¢KI£Øŗ¬ µķ·ŪČÜŅŗ£©”¢NaOH£Øŗ¬·ÓĢŖ£©”¢FeCl2£Øŗ¬KSCN£©ČÜŅŗø÷1µĪ£¬ĆæÖÖŅŗµĪ±Ė“Ė·ÖæŖ£¬Ī§³É°ė¾¶Š”ÓŚ±ķĆęĆóµÄŌ²ŠĪ£ØČēĻĀĶ¼ĖłŹ¾£©£¬ŌŚŌ²ŠÄ“¦·ÅÖĆ2Į£Ö„ĀéĮ£“󊔵ÄKMnO4¾§Ģ壬ĻņKMnO4¾§ĢåµĪ¼ÓŅ»µĪÅØŃĪĖį£¬ŌŁĮ¢¼“½«±ķĆęĆóøĒŗĆ£®£ØŅŃÖŖ£ŗ2KMnO4+16HCl£ØÅØ£©ØT2KCl+2MnCl2+5Cl2”ü+8H2O£©·ÖĪö £Ø1£©øßĆĢĖį¼Ų¾ßÓŠĒæŃõ»ÆŠŌ£¬ÄÜ°ŃŃĪĖįŃõ»ÆÉś³ÉĀČĘų£¬×ŌÉķ±»»¹ŌÉś³ÉĀČ»ÆĆĢ£¬¾Ż“ĖŠ“³ö·“Ó¦·½³ĢŹ½£»øßĆĢĖį¼ŲŹĒŃõ»Æ¼ĮŃĪĖįŹĒ»¹Ō¼Į£¬øł¾ŻøßĆĢĖį¼ŲŗĶ²Ī¼ÓŃõ»Æ»¹Ō·“Ó¦µÄŃĪĖįµÄ¼ĘĮæŹżÅŠ¶ĻŃõ»Æ¼ĮŗĶ»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±Č£»
£Ø2£©b“¦ĀČĘųÄÜÖĆ»»³öµā£¬µāÓöµķ·Ū±äĄ¶É«£¬ĀČ»ÆĢśŗĶĮņĒč»Æ¼ŲČÜŅŗ·“Ó¦Ź¹ČÜŅŗ³ŹŃŖŗģÉ«£»
£Ø3£©ĀČĘųŗĶĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘŗĶĖ®£»
£Ø4£©ŅĄ¾ŻŃõ»Æ»¹Ō·“Ó¦ÖŠŃõ»Æ¼ĮŃõ»ÆŠŌĒæÓŚŃõ»Æ²śĪļµÄŃõ»ÆŠŌÅŠ¶Ļ½ā“š£®
½ā“š ½ā£ŗ£Ø1£©e“¦²śÉś»ĘĀĢÉ«ĘųĢ壬ĖµĆ÷Éś³ÉĀČĘų£®ÓÉÓŚÓŠĀČ»ÆĆĢÉś³É£¬øł¾ŻŌ×ÓŹŲŗć»¹Éś³ÉĖ®£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ2KMnO4+16HCl£ØÅØ£©ØT2MnCl2+2KCl+5Cl2”ü+8H2O£¬Ąė×Ó·½³ĢŹ½ĪŖ2MnO4-+16H++10Cl-ØT2Mn2++5Cl2”ü+8H2O£¬·“Ó¦ÖŠMnŌŖĖŲ»ÆŗĻ¼ŪÓÉ+7¼Ū½µÖĮ+2¼Ū£¬ĖłŅŌŃõ»Æ¼ĮĪŖKMnO4£¬ClŌŖĖŲ»ÆŗĻ¼ŪÓÉ-1¼ŪÉżøßĪŖ0¼Ū£¬ĖłŅŌ»¹Ō¼ĮĪŖHCl£¬Ńõ»Æ¼ĮŗĶ»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ10=1£ŗ5£®¹Ź“š°øĪŖ£ŗ2MnO4-+16H++10Cl-ØT2Mn2++5Cl2”ü+8H2O£»1£ŗ5£»
£Ø2£©Éś³ÉµÄĀČĘųŌŚa“¦Óėµā»Æ¼Ų·“Ó¦£¬ÖĆ»»³öµā£¬æɹŪ²ģµ½ČÜŅŗÓÉĪŽÉ«±äĪŖĄ¶É«£¬Éś³ÉµÄĀČĘųŌŚd“¦ÓėĀČ»ÆŃĒĢś·“Ó¦£¬½«ŃĒĢśĄė×ÓŃõ»ÆĪŖĢśĄė×Ó£¬æɹŪ²ģµ½ČÜŅŗ±äĪŖŗģÉ«£¬¹Ź“š°øĪŖ£ŗČÜŅŗÓÉĪŽÉ«±äĪŖĄ¶É«£»ČÜŅŗ±äĪŖŗģÉ«£»
£Ø3£©ĀČĘųÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘŗĶ“ĪĀČĖįÄĘ£¬·“Ó¦µÄ·½³ĢŹ½ĪŖCl2+2NaOHØTNaCl+NaClO+H2O£¬¹Ź“š°øĪŖ£ŗCl2+2NaOHØTNaCl+NaClO+H2O£»
£Ø4£©Ńõ»Æ»¹Ō·“Ó¦ÖŠŃõ»Æ¼ĮŃõ»ÆŠŌĒæÓŚŃõ»Æ²śĪļµÄŃõ»ÆŠŌ£®
2KMnO4+16HCl£ØÅØ£©ØT2KCl+2MnCl2+5Cl2”ü+8H2OÖŠ£¬øßĆĢĖį¼ŲĪŖŃõ»Æ¼Į£¬ĀČĘųĪŖŃõ»Æ²śĪļ£¬ĖłŅŌŃõ»ÆŠŌ£ŗKMnO4£¾Cl2£»ĀČĘųÓė¶ž¼ŪĢśĄė×Ó·“Ӧɜ³ÉČż¼ŪĢśĄė×Ó£¬ŌņŃõ»ÆŠŌ£ŗCl2£¾FeCl3£»ĖłŅŌŃõ»ÆŠŌĖ³ŠņĪŖ£ŗKMnO4£¾Cl2£¾FeCl3£»¹Ź“š°øĪŖ£ŗÄÜ£»KMnO4£¾Cl2£¾FeCl3£®
µćĘĄ ±¾Ģāæ¼²éĮĖĀČĘųµÄŹµŃéŹŅÖʱøŗĶŠŌÖŹ¼ģŃ飬Ńõ»Æ»¹Ō·“Ó¦ÖŖŹ¶£¬ŹģĻ¤·“Ó¦ŌĄķ¼°Ńõ»Æ»¹Ō·“Ó¦¹ęĀÉŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1 mol•L-1 Na2CO3ČÜŅŗÖŠ£ŗc£ØHCO3-£©=2c£ØH2CO3£©+c£ØH+£©-c£ØOH-£© | |
| B£® | ĪļÖŹµÄĮæÅضČĻąµČµÄNa2SO3ŗĶNaHSO3ČÜŅŗÖŠ£ŗ3c£ØNa+£©=2[c£ØHSO3-£©+c£ØH2SO3£©+c£ØSO32-£©] | |
| C£® | Ķ¬ÅØ¶ČµÄĻĀĮŠČÜŅŗÖŠ£¬¢ŁNH4HSO4 ¢ŚNH4Cl ¢ŪNH3•H2O£¬c£ØNH4+£©Óɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ś£¾¢Ł£¾¢Ū | |
| D£® | ³£ĪĀĻĀ£¬ÅØ¶Č¾łĪŖ0.1mol/L NaAŗĶHAČÜŅŗÖŠpH=8£ŗc£ØHA£©£¾c£ØNa+£©£¾c£ØA-£©£¾c£ØOH-£©£¾c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 10mL 0.5mol/L CH3COONaČÜŅŗÓė6mL 1mol/LŃĪĖį»ģŗĻ£ŗc£ØCl-£©£¾c£ØNa+£©£¾c£ØCH3COO-£©£¾c£ØH+£©£¾c£ØOH-£© | |
| B£® | µČÅØ¶ČµÄĻĀĮŠĻ”ČÜŅŗ£ŗ¢ŁĮņĖįĒāÄĘ ¢ŚŅŅĖįÄĘ ¢Ū“×Ėį ¢ÜĢ¼ĖįĒāÄĘ ¢ŻĻõĖįÄĘ ¢Ž±½·ÓÄĘ£¬ĖüĆĒµÄpHÓÉŠ”µ½“óÅÅĮŠĪŖ£ŗ¢Ū¢Ż¢Ł¢Ü¢Ś¢Ž | |
| C£® | ³£ĪĀĻĀ0.1 mol/LµÄĻĀĮŠČÜŅŗ ¢ŁNH4Al£ØSO4£©2 ¢ŚNH4Cl ¢ŪNH3•H2O ¢ÜCH3COONH4ÖŠc £ØNH4+£©Óɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ś£¾¢Ł£¾¢Ü£¾¢Ū | |
| D£® | ŌŚ25”ꏱ£¬½«a mol•L-1µÄ°±Ė®Óė0.01 mol•L-1µÄŃĪĖįµČĢå»ż»ģŗĻ·“Ó¦Ź±ČÜŅŗÖŠc£ØNH4+£©=c£ØCl-£©£®ÓĆŗ¬aµÄ“śŹżŹ½±ķŹ¾NH3•H2OµÄµēĄė³£ŹżKb=$\frac{1{0}^{-9}}{a-0.01}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·“Ó¦ČČŗĶģŹ±äµÄµ„Ī»¶¼ŹĒkJ | |
| B£® | Čē¹ū·“Ó¦ŹĒŌŚŗćĪĀŗćŃ¹Ģõ¼žĻĀ½ųŠŠµÄ£¬“ĖŹ±µÄ·“Ó¦ČČÓėģŹ±äĻąµČ | |
| C£® | ČĪŗĪ»Æѧ·“Ó¦¶¼“ęŌŚ»ī»ÆÄÜ£¬ĒŅ²»æÉÄܽӽüÓŚĮć | |
| D£® | ČĪŗĪ»Æѧ·“Ó¦µÄ·“Ó¦ČČ¾łæÉĶعżŹµŃéÖ±½Ó²ā¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | AlCl3ČÜŅŗŗĶ°±Ė® | B£® | NaHCO3ČÜŅŗÓėCa£ØOH£©2ČÜŅŗ | ||
| C£® | Na HCO3ČÜŅŗŗĶŃĪĖį | D£® | Ć÷·ÆČÜŅŗŗĶÉÕ¼īČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 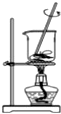 Õō·¢Ź³ŃĪĖ®µĆµ½ĀČ»ÆÄĘ¾§Ģå | B£® | 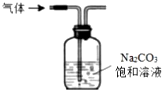 ³żČ„CO2ÖŠŗ¬ÓŠÉŁĮæHClĘųĢå | ||
| C£® | 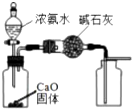 ÖĘČ”²¢ŹÕ¼ÆøÉŌļ“æ¾»µÄNH3 | D£® |  ŃéÖ¤SO2µÄ»¹ŌŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÅØÉÕ¼īČÜŅŗÖŠ¼ÓČėĀĮʬ£ŗAl+4OH-=AlO2-+2H2O | |
| B£® | ½«“ÅŠŌŃõ»ÆĢśČÜÓŚŃĪĖį£ŗFe3O4+8H+=3Fe3++4H2O | |
| C£® | ÓĆĢśµē¼«µē½āĀČ»ÆĢśČÜŅŗ£ŗ2Cl-+2H2O$\frac{\underline{\;µē½ā\;}}{\;}$2OH-+H2”ü+Cl2”ü | |
| D£® | µČĢå»ż”¢µČÅØ¶ČµÄBa£ØOH£©2Ļ”ČܽāÓėNH4HCO3Ļ”ČÜŅŗ»ģŗĻBa2++2OH-+NH4++HCO3-=BaCO3”ż+NH3•H2O+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ł¢Ś¢Ū | B£® | ¢Ł¢Ś¢Ś¢Ū | C£® | ¢Ś¢Ū¢Ś¢Ł | D£® | ¢Ł¢Ł¢Ś¢Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.28g | B£® | 1.4g | C£® | 1.68g | D£® | 2.1g |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com