
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | C12与水反应 C12+H2O═2 H++C1-+ClO- | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 碳酸氢钠溶液与足量盐酸反应:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、Ba2+、Cl-、NO3- | |
| B. | 使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO- | |
| D. | 在FeCl3溶液中:K+、Na+、SO42-、AlO2- |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
关于下列各图的叙述,正确的是( )

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj•mol﹣1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验项目 | 实验目的 | 实验步骤及现象 |
| A | 比较镁和铝的金属性强弱 | 将镁片和铝片用导线连接后,插入NaOH溶液中,镁片上有气泡冒出 |
| B | CO还原Fe2O3得到的黑色固体中是否有Fe3O4 | 黑色固体中加入盐酸溶解后再加入KSCN溶液,溶液不显红色 |
| C | 比较25℃时K(NH3•H2O)与K(HF)电离常数的大小 | 在25℃时,用pH计测定0.1mol/L的NH4F溶液的pH,pH=6.2 |
| D | 检验气体中是否含有乙烯 | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,紫色消失 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
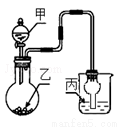
选项 | 液体甲 | 固体乙 | 溶液丙 | 丙中现象 |
A |
| NaHCO3 | 苯酚钠 |
|
B | 浓HCl | KMnO4 | 紫色石蕊 | 最终呈红色 |
C | 浓H2SO4 | Na2SO3 | 品红 | 红色变无色 |
D | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 |
A.A B.B C.C D.D
D.D
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:简答题
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8 kJ/mol、-283.0kJ/mol和-726.5kJ/mol。请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:___________________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
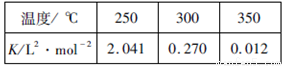

①该反应的平衡常数的表达式是____________,由表中数据判断△H_________0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为____________,则反应速率v(H2)=_____________。
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g) CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的½,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的½,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物 质的量浓度随时间变化的趋势示意图(其他条件不变,曲
质的量浓度随时间变化的趋势示意图(其他条件不变,曲 线上必须标明氢气、甲醇)。
线上必须标明氢气、甲醇)。
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的 电极反应式________________________。
电极反应式________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:填空题
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC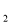 为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl
为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl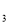 能与B、C的氢化物形成六配位的配合物,且B、C的氢化物物质
能与B、C的氢化物形成六配位的配合物,且B、C的氢化物物质 的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为 。
(2)A的氢化物中一种组成为A2H2分子,此分子A中原子轨道的杂化类型为 ,1 mol A2H2含σ键的数目为 。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为  。
。
(4)E的价电子排布式是 ,ECl3与B、C的氢化物形成的配合物的化学式为
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的 化学方程式是 。
化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com