
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ①③⑥ |
分析 根据影响反应速率的因素有温度、浓度、压强、催化剂以及接触面积分析:升温、增大物质的浓度、加压、使用催化剂、增大固体的接触面积反应速率加快,反之减慢来回答.
解答 解:①减小容器体积使增大压强,气体浓度增大,反应速率加快,故正确;
②增加碳的量,不能改变影响反应速率的因素,因为C是固体,故错误;
③恒容时通入CO2,其浓度增大反应时间加快,故正确;
④恒压下充入N2,各相关气体浓度减小,反应速率减慢,故错误;
⑤恒容下充入N2,各相关气体浓度不变,反应速率不变,故错误;
⑥降低温度,反应速率减慢,故错误;
故选C.
点评 本题主要考查学生外界条件对化学反应速率的影响,要求学生熟记结论,并灵活应用,题目较简单.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y形成化合物时,X可能显负价,也可能显正价 | |
| B. | 第一电离能X可能小于Y | |
| C. | X的最高价含氧酸的酸性强于Y的最高价含氧酸的酸性 | |
| D. | 原子序数X一定大于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1;2CO(g)+O2(g)═2CO2(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D在元素周期表中的位置第3周期,第VIA族.
,D在元素周期表中的位置第3周期,第VIA族.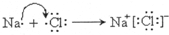 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$Xn-含有的中子数为a+b | |
| B. | ${\;}_{a}^{b}$Xn-含有的电子数为a-n | |
| C. | X原子的质量数为a+b+n | |
| D. | 一个X原子的质量约为$\frac{b}{6.02×1{0}^{23}}$ g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中电解质溶液能电离出自由移动的离子 | |
| B. | 有两根导线将两个活动性不同的电极连接 | |
| C. | 电极上进行的氧化还原反应的生成物为电子 | |
| D. | 电极上进行氧化还原反应时有电子的定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应是吸热反应,且A是气态 | |
| B. | 正反应是放热反应,且A不是气态 | |
| C. | 其他条件不变,加入少量A,该平衡不移动 | |
| D. | 改变压强对该平衡的移动无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烯的分子式:C2H4 | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | 丙烷分子的球棍模型是 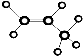 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com