
| A、HClO4、H3PO4、H2SiO3酸性依次增强 |
| B、O2-、Mg2+、Al3+的半径依次增大 |
| C、Na、Mg、Al还原性依次减弱 |
| D、HCl、HBr、HI稳定性依次增强 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
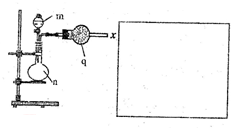 该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.
该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同种元素的原子均具有相同的质子数和中子数 |
| B、不同元素的原子构成的分子只含极性键 |
| C、第三周期中的非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱 |
| D、第ⅠA族和第ⅦA族元素从上到下随原子序数递增,单质的沸点均逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 胆矾 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 醋酸 | 氢气 |
| C | 碱石灰 | 石灰水 | 苛性钾 | 水 | 氨气 |
| D | 石灰石 | 水玻璃 | 氯化钙 | 氢氧化铁 | 碳酸钙 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管 |
| B、分液时,分液漏斗下端与烧杯内壁 |
| C、过滤时,烧杯内壁与漏斗下端 |
| D、过滤时,玻璃棒与三层滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com