
【题目】一种“全氢电池”的工作原理如图所示。下列说法不正确的是
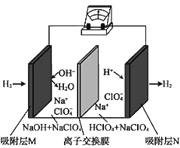
A.电子流向是从吸附层M通过导线到吸附层N
B.电池工作时,负极区pH减小
C.离子交换膜可用质子交换膜
D.负极的电极反应是:H2-2e-+2OH-=2H2O
科目:高中化学 来源: 题型:
【题目】室温下,取一定量冰醋酸,进行如下实验:
① 将冰醋酸配制成0.1 mol·L-1醋酸溶液;
② 取20 mL①所配溶液,加入a mL 0.1 mol·L-1 NaOH溶液,充分反应后,测得溶液pH=7;
③ 向②所得溶液中继续滴加稀盐酸,直至溶液中n(Na+) = n(Cl-)。
下列说法正确的是
A.①中:所得溶液的pH=1
B.②中:a=20
C.③中:所得溶液中c(CH3COO-)<c(H+),且pH<7
D.①与③所得溶液相比,等体积时所含CH3COOH分子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
A.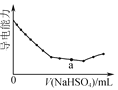 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
B.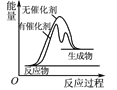 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C.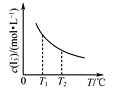 是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
D.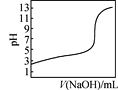 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
B.能使紫色石蕊试液变蓝的溶液:Ca2+、Na+、ClO-、I-
C.0.1 mol·L-1 NH4HCO3溶液:Ba2+、K+、OH-、NO3—
D.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中不正确的是( )
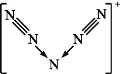
A. 每个N5+中含有35个质子和34个电子
B. 该离子中有非极性键和配位键
C. 该离子中含有4个π键
D. 与PCl4+互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行如下反应N2+3H2![]() 2NH3,下列情况一定能说明反应已达到平衡的是
2NH3,下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化
②单位时间内,有3molH2反应,同时有2molNH3生成
③气体的密度不随时间而变化
④单位时间内,有1molN2生成,同时有2molNH3生成
⑤用N2、H2、NH3表示的该反应的化学反应速率之比为1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A.在一定条件下,等物质的量的乙烯和苯分别和足量氢气发生加成反应,消耗氢气的物质的量之比为![]()
B.与甲烷、乙烯相比,苯的独特性质具体来说是易取代,能加成,难氧化
C.除去乙烷中混有的乙烯,应在一定条件下通入氢气,使乙烯转化为乙烷
D.某有机物的结构简式为![]() ,其分子结构中处在同平面内的原子最多有15个
,其分子结构中处在同平面内的原子最多有15个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
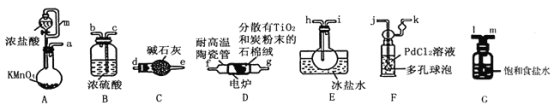
已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
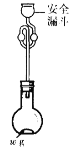
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述正确的是( )

A.a和b用导线连接时,铁电极上发生还原反应
B.a和b用导线连接时,电子经硫酸铜溶液从铁电极流向铜电极
C.无论a和b是否连接,铜电极质量都增加
D.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com