
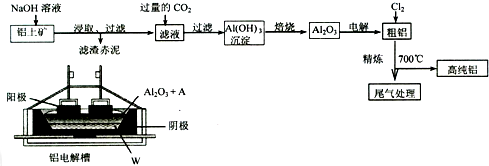
分析 氢氧化钠与氧化铁不反应,流程分析可知,铝土矿加入氢氧化钠溶液浸取过滤,滤渣为氧化铁,滤液中加入过量二氧化碳得到氢氧化铝沉淀,焙烧得到氧化铝,氧化铝电解得到粗铝,粗铝在坩埚中精炼高温通入氯气,将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去,得到高纯铝液,气体冷却得到氯化铝固体,镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,通过电镀在表面镀铝.
(1)氧化铝和氢氧化钠反应生成偏铝酸钠和水,滤液中含有偏铝酸钠,通入过量CO2发生反应生成氢氧化铝沉淀和碳酸氢根离子;
(2)电解氧化铝阳极氧离子放电生成氧气,阴极铝离子放电生成铝单质,所以W为铝,Al2O3的熔点很高,熔化需要较多能量,加入冰晶石可以降低Al2O3的熔化温度.根据质量守恒定律书写该化学方程式;
(3)根据题中信息:NaCl熔点为801℃;AlCl3在181℃升华,在结合物质之间的反应来分析;
(4)依据铝性质活泼,容易与氧气反应生成氧化铝,结合氧化铝性质解答;
(5)根据铝元素守恒分析解答.
解答 解:(1)氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应为:Al2O3+2OH-=2AlO2-+H2O,氢氧化钠与氧化铁不反应,所以赤泥中的主要成分是Fe2O3,滤液中含有偏铝酸钠,通入过量CO2所发生反应的离子方程式为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
故答案为:Fe2O3;AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(2)电解氧化铝阳极氧离子放电生成氧气,阴极铝离子放电生成铝单质,W为阴极产物,所以W为铝,Al2O3的熔点很高,熔化需要较多能量,加入冰晶石可以降低Al2O3的熔化温度,即助熔剂,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,根据质量守恒定律书写该化学方程式为:2Al(OH)3+12HF+3Na2CO3 =2Na3AlF6+3CO2+9H2O;
故答案为:Al;Na3AlF6;助熔剂(或降低熔化温度);2Al(OH)3+12HF+3Na2CO3$\frac{\underline{\;高温\;}}{\;}$2Na3AlF6+3CO2+9H2O;
(3)粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,其中氯化钠熔点为801℃,较高,是固态杂质随气泡上浮,气泡的主要成分除Cl2外还含有H2、HCl、AlCl3;
故答案为:H2、HCl和AlCl3;NaCl;
(4)铝金属表面形成的致密氧化铝膜具有保护作用,致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生,
故答案为:表面形成的致密氧化铝膜能防止钢材腐蚀;
(5)含Al2O368%的铝土矿100吨,含有铝的物质的量为$\frac{100×1{0}^{6}g×68%}{102g/mol}×2$,浸取率为90%,损失了5.00%的铝,可制得含铝99.0%的高纯铝的物质的量为[$\frac{100×1{0}^{6}g×68%}{102g/mol}×2$×90%×(1-5%)]÷99%,质量为:$\frac{100×1{0}^{6}×68%×2×0.9×0.95}{102×0.99}×27$≈31.1吨,
故答案为:31.1吨.
点评 本题工艺流程,设计铝制备,工业电镀铝,明确铝及其化合物性质是解题关键,注意电解池工作原理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比氟化氢的沸点高 | |
| D. | 第三周元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有Fe3+ |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
| C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰颜色为紫色 | 原溶液中一定只含K+ |
| D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5 种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在碱金属元素中,所有碱金属的氧化物(包括过氧化物)均属于碱性氧化物 | |
| B. | 由于钠、钾的密度都小于1,所以,碱金属单质的密度都小于1 | |
| C. | 金属锂不能保存于煤油中,金属钾可以保存于煤油中 | |
| D. | 虽然自然界含钾的物质均易溶于水,但土壤中钾含量太少,故需施用钾肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在H2O2参与的反应中,1 mol H2O2得到或失去的电子数一定是2NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{a}$(N-a) mol | B. | $\frac{a}{A+n}$(n+A)mol | C. | $\frac{A}{a+n}$(N+n) mol | D. | $\frac{a}{A+n}$(A-N+n) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com