
【题目】2017年科学工作若研究的两项最新成果如下:
I.4-一二甲氨基吡啶( )能高效催化醋酸酐和磺胺的反应。
)能高效催化醋酸酐和磺胺的反应。
II.钙钛矿制作的一种新材料推进了人工光合作用的进程。
请回答以下问题:
(1)基态钛原子的价电子排布式为_____________________。
(2)①构成4—二甲氨基吡啶分子的各原子电负性由大到小的顺序为_____________,其中元素第一电离能最大的是_________________。
②1mol4—二甲氨基吡啶分子中所含σ键的数目为_____________,其中C原子的杂化形式为____________。(3)乙酰氯(CH3COCl)和乙酸钠(CH3COONa)反应可以制备醋酸酐。这两种反应物中熔点更高的是_____,原因是_______________________________。
(4)自然界中除钙钛矿外,碳酸钙、硫酸钙也都是钙元素形成的常见物质。请比较键角的大小:CO32-_____SO42-(填“>”“<”或“=”),推断依据是_________________________________。
(5)钙钛矿有多种晶胞结构,其中一种晶胞结构如图所示
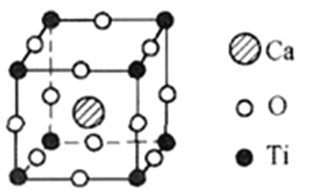
①此钙钛矿晶胞中,Ca2+周围距离最近且相等的Ca2+个数为__________________________。
②已知该晶胞的密度为d g/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数a=_______pm。(写出表达式,不需要进行计算)
【答案】 3d24s2 N、C、H或N>C>H N或氦 19NA(或19×6.02×1023或1.1438×1024) sp3、sp2 乙酸钠(或CH3COONa) 乙酸钠晶体是离子晶体,乙酰氯晶体是分子晶体 > CO32-中C原子为SP3杂化,键角120°,SO42-中S原子为SP3杂化,键角109°28′ 6 (136/dNA)(1/3)×1010或![]() ×1010或2×
×1010或2×![]() ×1010
×1010
【解析】试题分析:本题以.4-一二甲氨基吡啶和钙钛矿为背景,主要考查价电子排布、电负性、第一电离能、σ键、中心原子杂化、不同晶体熔点比较、晶胞的有关计算等知识,考查考生对原子结构和元素周期律的认识、晶体有关的简单计算能力、对晶体图形的阅读能力和基础知识的综合运用能力。
解析:(1)钛是22号元素,其基态电子排布式为1s22s22p63s23p63d24s2,价电子排布式为3d24s2。正确答案:3d24s2。(2)①构成4—二甲氨基吡啶的原子有C、N、H,C、N同处于第二周期,随着原子序数增大,同周期从左到右电负性增大,而H位于第一周期,电负性较小,所以电负性N>C>H。同一周期,从左到右各元素的第一电离能总体呈增大的趋势,但是当原子的价电子为全满或者半满时呈现为一种较稳定状态,所以它们的第一电离能比相邻的原子都要大,既N的第一电离能比相邻的C大,而H位于第一周期第一电离能较小,因此三种元素的第一电离能最大的是N元素。②根据4—二甲氨基吡啶的结构,1mol该分子中含σ键包括六元环中6mol σ键及上下(原图方向,下同)4个C原子的4mol C—H σ键、向左1molC—N σ键、再向左上、左下各有1mol C—N σ键及左侧两个C原子各有3molC—H σ键,共计为19mol。分子中C原子的杂化方式有最左侧—CH3中C原子sp3杂化及苯环上C原子sp2杂化。正确答案:N>C>H、N、19mol(或19×6.02×1023或1.1438×1025) 、 sp3和sp2。(3)乙酰氯分子中只存在共价键,晶体属于分子晶体,乙酸钠存在离子键属于离子晶体,所以乙酸钠的熔点更高。正确答案:乙酸钠(或CH3COONa)、乙酸钠晶体是离子晶体,乙酰氯晶体是分子晶体。(4)CO32-中心原子C采用sp2杂化,键角1200,SO42-中心原子S采用sp3杂化,键角为109°28′,所以键角的大小:CO32->SO42-。正确答案:>、CO32-中C原子为SP3杂化,键角120°,SO42-中S原子为SP3杂化,键角109°28′ 。(5)钙钛矿晶胞中Ca2+周围距离最近且相等的Ca2+离子有上、下、左、右、前、后(均为相对于图中晶胞的位置)各有一个共计6个。由晶胞结构可以推出晶胞中含有1个Ca原子、![]() 个Ti原子、(3)
个Ti原子、(3)![]() 个O原子,所以每个晶胞的质量为
个O原子,所以每个晶胞的质量为![]() ,晶胞体积为(a×10-10)3 cm3 ,密度
,晶胞体积为(a×10-10)3 cm3 ,密度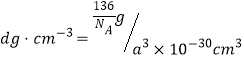 ,所以
,所以![]() 。正确答案:6、
。正确答案:6、![]()


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。


(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制作红色烟火、光学玻璃、电子管阴极材料等。由工业级硝酸锶(含有硝酸钡、硝酸钙等杂质)提取高纯硝酸锶的流程如下:

(1)滤液1中的主要溶质是___________(填化学式)。
(2)相对于水洗,滤渣1用浓硝酸洗涤的优点是________________________________。
(3)滤液2中过量的铬酸洗液被N2H4还原产生Cr3+和一种不污染环境的气体。该反应的离子方程式为______________________________________。
(4)滤渣3的主要成分是_____(填化学式);滤液3中c(Cr3+)=_____mol/L(常温下Ksp[Cr(OH)3]=6.3×10-31)。
(5)操作X为_____________;Sr(NO3)2·nH2O转化为高纯硝酸锶的过程温度要控制在100℃,目的是_________________。
(6)为测定Sr(NO3)2·nH2O的数值n,将7.44g Sr(NO3)2·nH2O晶体在100℃加热至恒重为6.36g的高纯硝酸锶。计算得n=______(M[Sr(NO3)2]=212g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是一种治疗脑血管疾病的常用药,它可以用烃A 为原料按以下路线合成:
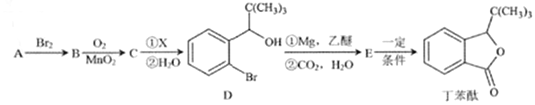
已知:I.A的质谱如下图所示;

II.C能发生银镜反应
III. 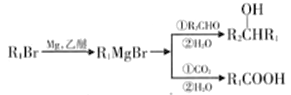
回答以下问题:
(1)A的名称是______________;丁苯酞所含官能团的名称是________________________。
(2)A→B的反应类型是________________;A→B的反应条件是___________________________。
(3)C的结构简式为________________________。
(4)E![]() 丁苯酞的反应方程式为_________________________。
丁苯酞的反应方程式为_________________________。
(5)芳香族化合物H与E所含官能团的种类和数目相同,H比E的相对分子质量小56.1mol H分别与NaOH溶液和NaHCO3溶液反应,消耗NaOH和NaHCO3的物质的量之比为2:1,则符合条件的H的结构有_____种;其中在核磁共振氡谱图中有5组吸收峰,峰面积之比为1:1:2:2:2的结构简式为_________________。
(6)参照题目信息,写出以![]() 为原料,制备
为原料,制备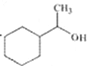 的合成路线(无机试剂及2个碳原子以内的有机试剂任选):____________________________________。
的合成路线(无机试剂及2个碳原子以内的有机试剂任选):____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
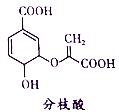
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/L'HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
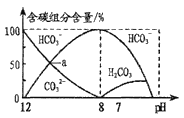
下列说法正确的是
A. 在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B. a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C. 当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D. 当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β-羰基酯,同时失去一分子醇,该反应称克菜森(R·L·Claisen)酯缩合反应,其反应机理如下:
2RCH2COOC2H5 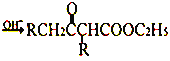 +C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
+C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
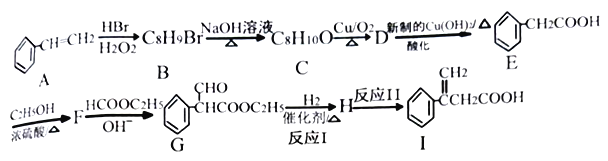
回答下列问题:
(1)E的名称为_______,F的结构简式为_______。
(2)I中官能团的名称是_______,反应I的反应类型是_______。
(3)F→G反应的化学方程式为_______。
(4)满足下列条件E的同分异构体有_____种。
①含有苯环,能发生水解反应 ②分子结构中含有一个甲基
其中分子结构中只有一个侧链的有机物结构简式为______、_______。
(5)乙酰乙酸乙酯(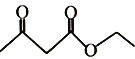 )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com