
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生的污染,其工作原理如图所示。下列说法正确的是
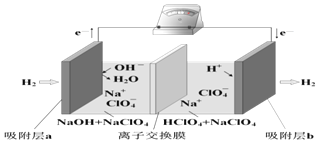
A.NaClO4的作用是传导离子和参与电极反应
B.吸附层b的电极反应:H2-2e-+2OH-=2H2O
C.全氢电池工作时,将酸碱反应的中和能转化为电能
D.若离子交换膜是阳离子交换膜,则电池工作一段时间后左池溶液pH基本不变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
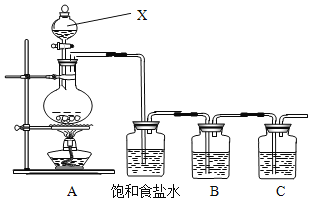
(1)请写出A装置中发生反应的化学方程式_____。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),反应离子方程式是_____。
A.N![]() S溶液 B.N
S溶液 B.N![]() S
S![]() 溶液 C.N
溶液 C.N![]() S
S![]() 溶液
溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比![]() S稳定 ②HClO氧化性比
S稳定 ②HClO氧化性比![]() S
S![]() 强 ③HCl
强 ③HCl![]() 酸性比
酸性比![]() S
S![]() 强 ④HCl酸性比
强 ④HCl酸性比![]() S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C
S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C![]() 反应生成FeC
反应生成FeC![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
(5)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CC![]() ,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列叙述不正确的是( )
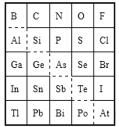
A.Pb的最高正价为+4B.原子半径比较:Al>F
C.酸性强弱:H3AsO4<H2SeO4D.Br的最高价氧化物对应水化物的化学式为HBrO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,氮氧化物进行治理已成为环境科学的重要课题。
(1)在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示。
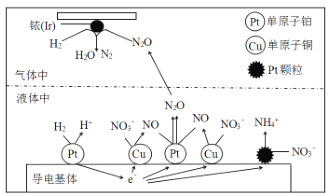
金属铱(Ir)表面发生了氧化还原反应,其还原产物的电子式是_____;若导电基体上的Pt颗粒增多,不利于降低溶液的含氮量,用电极反应式解释原因 _____________。
(2)在密闭容器中充入 10 mol CO和8 mol NO,发生反应 2NO(g)+2CO(g)![]() N2(g) +2CO2(g) H<0,如图为平衡时NO的体积分数与温度、压强的关系。
N2(g) +2CO2(g) H<0,如图为平衡时NO的体积分数与温度、压强的关系。
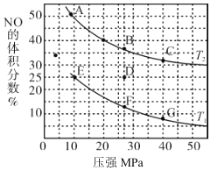
①该反应达到平衡后,为提高反应速率且同时提高转化率,可采取的措施有_______(填序号)。
a.改用高效催化剂 b.缩小容器的体积
c.升高温度 d.减小CO2的浓度
②压强为20 MPa、温度为T2下,若反应达到平衡状态时容器的体积为4 L,则此时CO2的浓度为_______。
③若在D点对反应容器升温的同时增大其体积至体系压强减小,重新达到的平衡状态可能是图中A ~G点中的_______点。
(3)研究表明,NOx的脱除率除与还原剂、催化剂相关外,还与催化剂表面氧缺位的密集程度成正比。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:NO(g)+□→NO(a) ΔH1 K1 2NO(a)→2N(a)+O2(g) ΔH2 K2
2N(a)→N2(g)+2□ ΔH3 K3 2NO(a)→N2(g)+2O(a) ΔH4 K4
2O(a)→O2(g)+2□ ΔH5 K5
注:“□”表示催化剂表面的氧缺位,“g”表示气态,“a”表示吸附态。
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是________________。第二阶段中各反应焓变间的关系:H2+H3=_____;该温度下,NO脱除反应2NO(g)![]() N2(g)+O2(g)的平衡常数K=____ (用含K1、K2、K3的表达式表示)。
N2(g)+O2(g)的平衡常数K=____ (用含K1、K2、K3的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从制溴苯的实验中分离出FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是

A.用装置甲制取氯气按图示通入装置乙中能使Br-全部转化为溴单质
B.用装置丙分液时先从下口放出水层,换一容器从上口倒出有机层
C.检验溶液中是否氧化完全,取水层少许滴加硝酸银溶液,看有无沉淀生成
D.用装置丁将分液后的水层溶液蒸发至有大量晶体析出时,停止加热,余热蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2 O42-) =0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
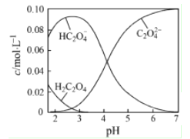
A.由图可知:Ka2(H2C2O4)的数量级为10-4
B.若将0.05mol NaHC2O4和0.05mol Na2C2O4固体完全溶于水配成1L溶液,所得混合液的pH为4
C.c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
D.用标准的氢氧化钠溶液滴定H2C2O4溶液,可用酚酞做指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究足量的铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。
已知:①SO2难溶于饱和亚硫酸氢钠溶液。②SO2能与酸性高锰酸钾溶液发生氧化还原反应。请回答下列问题:

(1)装置A中发生的化学反应方程式为____________;此反应表明浓硫酸具有_________(填字母)。
a. 酸性 b. 脱水性 c. 强氧化性 d. 吸水性
(2)装置D中试管口放置的棉花中浸入__________溶液,其作用是_____________。
(3)装置B的作用是贮存多余的气体,B中应放置的液体是__________(填字母)。
a. 水 b. 饱和NaHSO3溶液 c. 酸性KMnO4溶液 d. NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________(填字母)。
a. 银粉 b. 铁粉 c. BaCl2溶液 d. NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时将a g NH3完全溶于水得到V mL溶液,该溶液的密度为ρg·cm-3,质量分数为w。下列说法正确的是
A. 溶质的质量分数w=a/(Vρ-a)×100%
B. 溶质的物质的量浓度c= a/17V mol·L-1
C. 溶液密度ρ可表示为 17c/w g·cm-3
D. 上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨—水体系中不断通入CO2,各种粒子的浓度变化趋势如图所示。下列说法不正确的是
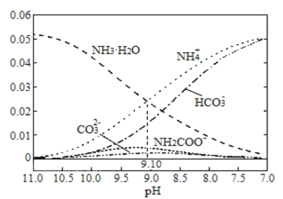
A.40℃时,K(NH3·H2O)=10-9.10
B.不同pH的溶液中均存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,![]() 不断减小
不断减小
D.随溶液pH不断降低,生成的中间产物NH2COONH4又不断转化为NH4HCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com