
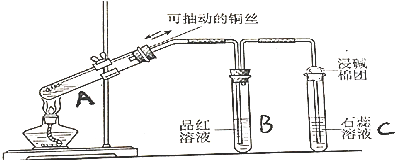
分析 (1)A试管中铜与浓硫酸在加热条件下反应生成二氧化硫、硫酸铜和水;
(2)由于A试管中有空气,所以在开始时B试管中起始出现的气泡应为空气;
(3)二氧化硫能使品红褪色,加执之后又能恢复红色,据此可判断是否为二氧化硫使品红褪色;
(4)二氧化硫溶于水形成亚硫酸,溶液呈酸性,会使石蕊变红;
(5)二氧化硫有毒,会污染空气,所以多余的二氧化硫要用碱溶液吸收;
(6)铜与浓硫酸反应生成硫酸铜,过量的硫酸溶于水会放热,同时硫酸铜溶于水溶液呈蓝色;
(7)在浓硫酸存在的条件下,反应生成的硫酸铜是白色固体;
(8)CuO与稀硫酸反应生成蓝色的硫酸铜溶液,而CuS、Cu2S均为黑色固体,不溶于水和稀硫酸;
解答 解:(1)A试管中铜与浓硫酸在加热条件下反应生成二氧化硫、硫酸铜和水,反应方程式为 Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)由于A试管中有空气,所以在开始时B试管中起始出现的气泡应为空气,
故答案为:空气;
(3)二氧化硫能使品红褪色,加执之后又能恢复红色,所以实验完毕后取下B试管,加热,若溶液 红色加深 (溶液变红)可证明使品红褪色的物质为SO2,
故答案为:加热;红色加深 (溶液变红);
(4)二氧化硫溶于水形成亚硫酸,溶液呈酸性,会使石蕊变红,所以C试管中出现的现象是紫色石蕊试液变红,
故答案为:紫色石蕊试液变红;
(5)二氧化硫有毒,会污染空气,所以多余的二氧化硫要用碱溶液吸收,所以湿碱棉团的作用是吸收SO2尾气,防止环境污染,
故答案为:吸收SO2尾气,防止环境污染;
(6)铜与浓硫酸反应生成硫酸铜,过量的硫酸溶于水会放热,同时硫酸铜溶于水溶液呈蓝色,溶液温度升高的原因是反应物中浓硫酸过量,溶于水时大量放热,
故答案为:反应物中浓硫酸过量,溶于水时大量放热,故溶液温度升高;
(7)在浓硫酸存在的条件下,反应生成的硫酸铜是白色固体,
故答案为:无水硫酸铜;
(8)CuO与稀硫酸反应生成蓝色的硫酸铜溶液,而CuS、Cu2S均为黑色固体,不溶于水和稀硫酸,所以证明黑色沉淀中有无CuO的实验操作为取少量沉淀加入稀硫酸,若溶液变蓝则黑色沉淀中有CuO,若溶液不变蓝,则无CuO,
故答案为:取少量沉淀加入稀硫酸,若溶液变蓝则黑色沉淀中有CuO,若溶液不变蓝,则无CuO;
点评 本题主要考查了铜和浓硫酸反应过程的探究,抓住反应过程中出现的现象来分析问题是解题的关键,侧重考查学生分析问题和灵活运用实验基础知识的能力,难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| HF | HClO | H2S | C6H5OH |
| Ki=3.53×l0-4 | Ki=2.95×l0-8 | K1=9.1×l0-8 K2=1.1×l0-12 | Ki=1.28×l0-10 |
| A. | ClO-+H2S→HClO+HS- | B. | H2S+2C6H5O-→2C6H5OH+S2- | ||
| C. | HF+C6H5O-→C6H5OH+F- | D. | HF(少量)+S2-→F-+HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征为均匀稳定 | |
| B. | 胶体和溶液可以通过丁达尔效应来鉴别 | |
| C. | 可以用饱和氯化铁溶液和氢氧化钠溶液混合来制取氢氧化铁胶体 | |
| D. | 可以用过滤的方法净化胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Al(OH)3 | C. | FeSO4 | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
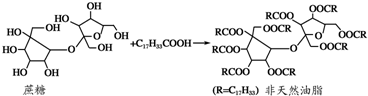
| A. | 该非天然油脂结构中含有2种官能团 | |
| B. | 油酸与蔗糖发生的反应类型属于取代反应 | |
| C. | 该非天然油脂能与氢氧化钠溶液、溴的四氯化碳溶液发生反应 | |
| D. | 蔗糖分子可以看作是两个不同的单糖分子间脱去一个水分子形成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列不存在丁达尔效应的分散系是
A.有尘埃的空气 B.纯水
C.食盐水 D.向沸水中滴入FeCl3饱和溶液所得液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com