
����Ŀ����ҩ������ҽѧ��Խ��Խ�ܵ���ע����ҩҩ����˪����Ҫ�ɷ�As2O3�����������Ƽ���Ѫ����Ϊ�ˣ��鼰�仯�������ȡ�ٴ������ע��
��1��As��ԭ�ӽṹʾ��ͼΪ ![]() �����������ڱ��е�λ���� ��
�����������ڱ��е�λ���� ��
��2��NԪ�طǽ����Ա�Asǿ������˵����ȷ���� �� ��NH3�����ȶ��Ա�AsH3��
��HNO3�����Ա�H3AsO4ǿ
��N��ԭ�Ӱ뾶��As��ԭ�Ӱ뾶С
��3��������ͼд��As2O5�ֽ�ΪAs2O3���Ȼ�ѧ����ʽ �� 
��4��������֪�����Դ����飨As2S3����������ȡAs2O3 �� ��ȡ�Ĺ������̼�ͼ���£� 
��As2S3��Na3AsS3�е�S��Ϊ��2�ۣ���������з����ķ�Ӧ����ǡ����ǡ���������ԭ��Ӧ��
�ڹ��̢��ϵ�в������� ��
��д�����̢�����ӷ���ʽ ��
���̢��У�����Խǿ��As2O3�IJ���Խ�ߣ��������ԭ�� ��
���𰸡�
��1���������ڣ�VA��
��2���ڢ�
��3��As2O5��s���TAs2O3��s��+O2��g����H=+295.4kJ?mol��1
��4�����ǣ�Ũ���ᾧ�����ˣ�ϴ�ӣ���ɣ�2AsO43��+2SO2+2H+�TAs2O3+2SO42��+H2O������Խǿ�����ʵ������Ի���ԭ�Կ�����ǿ������������Ũ��ƽ�������ƶ��ٽ���Ӧ�Ľ��У����������As2O3�IJ���
���������⣺��1��As��ԭ�ӽṹʾ��ͼ��4�����Ӳ㣬�������5�����ӣ�λ�ڵ������ڣ�VA�壬���Դ��ǣ��������ڣ�VA�壻��2��Ԫ�طǽ�����Խǿ����Ӧ�⻯������ȶ���Խ�ã�����������Ӧˮ���������Խǿ���ǽ�����N��As����NH3�����ȶ��Ա�AsH3�ã���HNO3�����Ա�H3AsO4ǿ��As���Ӳ�����N��2��N��ԭ�Ӱ뾶��As��ԭ�Ӱ뾶С��
���Դ��ǣ��ڢۣ���3�����ݸ�˹���ɿ�֪����Ӧ��������أ�ֻ��ʼ̬����̬�йأ���As2O5��s��Ϊʼ̬��As��s��5/2O2�� g��Ϊ��̬����ͼ��֪����H+|��H1|=|��H2|����H=|��H2|��|��H1|=914.6kJ/mol��619.2kJ/mol=+295.4kJ/mol��
���Դ��ǣ�As2O5��s���TAs2O3��s��+O2��g����H=+295.4 kJmol��1����4���ټ��������û��Ԫ�ػ��ϼ۵ı仯��
���Դ��ǣ����ǣ��ڹ��̢�Ϊ��Һ�����壬��Ҫ����Ũ���ᾧ�����ˣ�ϴ�ӣ����
���Դ��ǣ�Ũ���ᾧ�����ˣ�ϴ�ӣ���ɣ��۹��̢�����Ӧ�����ӷ���ʽΪ2AsO43��+2SO2+2H+�TAs2O3+2SO42��+H2O������Խǿ�����ʵ������Ի���ԭ�Կ�����ǿ������������Ũ��ƽ�������ƶ��ٽ���Ӧ�Ľ��У����������As2O3�IJ��ʣ�
���Դ��ǣ�2AsO43��+2SO2+2H+�TAs2O3+2SO42��+H2O������Խǿ�����ʵ������Ի���ԭ�Կ�����ǿ������������Ũ��ƽ�������ƶ��ٽ���Ӧ�Ľ��У����������As2O3�IJ��ʣ�
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�����֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ�����ȷ�����⣮


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о�С���������ͼװ���Ʊ��������Ȼ�����
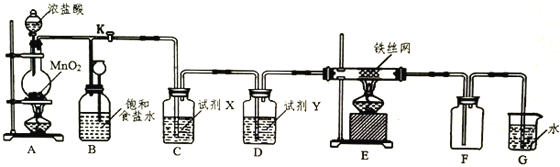
���ϣ�
���Ȼ�����ˮ�ܷ������ҷ�Ӧ����Fe(OH)3��
��CCl4������ˮ���ܶȴ���ˮ����Cl2��CCl4�е��ܽ��Զ����ˮ�е��ܽ�ȡ�
�ش��������⣺
��1���Լ�X��������__________________���Լ�Y��__________________��
��2��ʵ������У�A��E�����оƾ��ƣ�Ӧ�ȵ�ȼ___________���A����E��������ʵ����Ϻر�����K��Ϩ��ƾ��ƣ��������ȵ����ã�A����������Cl2��������ʱB�е�������______________��B��������______________________��
��3����������ȡ20mLG����Һ�������ܷ������õķ�Һ©���У�Ȼ����ע��10mL CCl4���Ǻò������������á���Һ���ֱ�ȡ�ϲ�Һ���²�Һ������ɫ�����ϣ���ʹ��ɫ������ɫ����__________����ϲ�Һ�����²�Һ������
��4��д��װ��A�з�Ӧ�����ӷ���ʽ��_____________________________��ʵ��������װ��E�е���˿����������mg����������װ��A�з�Ӧת�Ƶ��ӵ����ʵ���Ϊ_________mol���ú�m��ʽ�ӻش𣩡�
��5����ͬѧ��Ϊ����װ�ô��ڲ��㣬�ø�װ����ȡ���Ȼ����л������������ʣ�������������������иĽ����������ĸĽ��취_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ��̽��п�����ᷴӦ���̵����ʱ仯�Լ�Ӱ�췴Ӧ���������أ���100 mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼�����ʾ(�ۼ�ֵ)��
ʱ��/min | 1 | 2 | 3 | 4 | 5 |
�������/mL | 50 | 120 | 232 | 290 | 310 |
(1)��Ӧ��������ʱ���(ָ0��1��1��2��2��3��3��4��4��5 min)��_______________min����ʱ����������Ũ�ȱ仯��ʾ�ĸ÷�Ӧ��������______________________����Ӱ�췴Ӧ���ʵ������������ԭ����_______________________________________��
(2) ��Ӧ������С��ʱ���(ָ0��1��1��2��2��3��3��4��4��5 min)��_____________min��ԭ����_______________________________________________��
(3)�����Ӧ���ھ��ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ������������������������зֱ����������������Һ������Ϊ���е���________(����ĸ)��
A.����ˮ B.NaCl��Һ C.NaNO3��Һ D.CuSO4��Һ E.Na2CO3��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaI��NaBr�Ļ����Һ��ͨ�������Cl2����ַ�Ӧ����Һ���ɡ����ղ�������ʣ��������ǣ� ��
A��NaCl��I2��Cl2 B��NaCl��I2 C��NaCl��NaBr D��NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ(ʡ�Լгֺ;���װ��)�����ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����(����)

ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | п�� | H2 | NaOH��Һ |
D | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ�������з�Ӧ�����ӷ���ʽΪ�� ��
A.�ô����ȥˮ����2H++CaCO3=Ca2++CO2��+H2O
B.��������Ũ�����ϼ��ȣ�2H++FeS=H2S��+ Fe2+
C.����������Һ�еμ�̼������Һ��2Al3++3 ![]() =Al2(CO3)3��
=Al2(CO3)3��
D.������������Һ���չ�ҵ�����е�NO2��2NO2+2OH= ![]() +
+ ![]() + H2O
+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʳΪ�죬ʳ��Ϊ�ȡ�������������Σ��ʳƷ��ȫ���ǣ� ��
A.���ղ������ͼӹ��ɻ���ԭ��
B.���߲˹Ϲ�������ȩ��Һ
C.����ʳ�м�������ʳƷ���Ӽ�
D.ʳ�μӵ⡢���ͼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹ��˲�����˵���У�������ǣ�������
A. �������¶�Ҫ����������ֽ��
B. ��ֽ��Ե����©����Ե�����ಿ��Ҫ��ȥ������ˮ��ʪ��������������
C. ����ʱ��Һ���ز�����ע�����������ʹҺ�������ֽ��Ե
D. ©���¶˽����ձ��ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL pH=3�Ĵ�����Һ�м�ˮϡ�ͺ�����˵����ȷ���ǣ� ��
A.��Һ�е������ӵ���Ŀ����
B.�ټ���10mL pH=11��NaOH��Һ�����ҺpH=7
C.����ĵ���̶�����c��H+��������
D.��Һ�� ![]() ����
����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com