
下列说法中正确的是( )。
A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B.NH3、H2O、CH4分子的几何构型均为三角锥形
C.NH3、H2O、CH4分子中的N、O、C原子均是采取sp2杂化的
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1
科目:高中化学 来源:2014年高考化学 题型一 化学社会型专题练习卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
A.在有机化工中,氯气是合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:填空题
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是____________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。据此判断三氯化铁晶体为________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
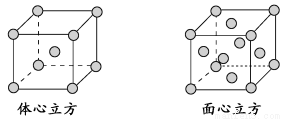
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3.4几类其他聚集状态物质练习卷(解析版) 题型:选择题
下列关于物质的聚集状态的叙述中,错误的是( )。
A.物质只有气、液、固三种聚集状态
B.气态是高度无序的体系存在状态
C.固态中的原子或者分子间结合较紧凑,相对运动较弱
D.液态物质的微粒间距离和作用力的强弱介于固、气两态之间,表现出明显的流动性
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2章化学键分子间作用力练习卷(解析版) 题型:填空题
A、B、C、D四种元素处于同一短周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻。
请填空:
(1)在B的单质分子中存在________个π键,________个σ键。
(2)已知B的气态氢化物很容易与H+结合,B原子与H+间形成的键叫________,形成的离子立体构型为________,其中B原子采取的杂化方式是________。
(3)在A、B、C、D四种元素形成的电子数相同的四种氢化物中,沸点最低的是________(写分子式),其沸点显著低于其他三种氢化物的原因是:________________________。
(4)A的氢化物易溶于水,而D的氢化物难溶于水,原因是___________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.3离子键配位键与金属键练习卷(解析版) 题型:选择题
下列叙述错误的是( )。
A.离子键没有方向性和饱和性,而共价键有方向性和饱和性
B.两种不同的非金属元素可以组成离子化合物
C.配位键在形成时,是由成键双方各提供一个电子形成共用电子对
D.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.3离子键配位键与金属键练习卷(解析版) 题型:选择题
具有下列电子排布的原子中最难形成离子键的是( )。
A.1s22s22p2 B.1s22s22p5
C.1s22s22p63s2 D.1s22s22p63s1
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.3原子晶体与分子晶体练习卷(解析版) 题型:选择题
下列性质适合于分子晶体的是( )。
A.熔点1 070 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液导电
C.难溶于CS2,熔点1 128 ℃,沸点4 446 ℃
D.熔点97.81 ℃,质软导电,密度0.97 g·cm-3
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.1共价键练习卷(解析版) 题型:选择题
下列有关σ键和π键的说法错误的是( )。
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com