
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$分别计算出所含分子数之比、物质的量之比,再根据相同条件下气体密度与摩尔质量成正比计算二者密度之比.
解答 解:根据n=$\frac{m}{M}$可知,相同质量的CO和CO2的物质的量与摩尔质量成正比,则二者物质的量之比=44g/mol:28g/mol=11:7,根据N=nNA可知CO和CO2所含的分子数之比=物质的量之比=11:7;
等质量的CO和CO2所含原子的物质的量之比=(11×2):(7×3)=22:21;
同温同压下,气体密度与摩尔质量成正比,则二者密度之比=28g/mol:44g/mol=7:11,
故答案为:11:7; 22:21;7:11.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与其它物理量之间的关系即可解答,试题有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
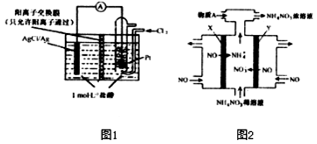 氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
氧化还原反应与生产、生活、科技密切相关,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
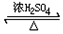 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
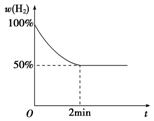 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 可逆反应进行的程度是不可改变的 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 能自发进行的化学反应,一定是△H<0、△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com