
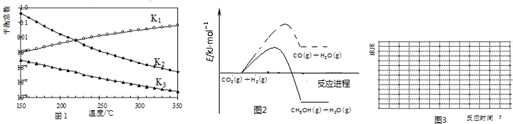
分析 (1)曲图l可知,随着温度升高,K1增大,K2、K3减小,则△H1>0,△H2<0、△H3<0,根据盖斯定律得△H3=△H1+△H2,所以△H2<△H3;
(2)反应1是吸热反应,可自发进行,熵值必然增大,△S1>0,△G=△H-T△S,△G<0时,反应可自发进行,△H>0,△S>0,只有当T较大时,△G<0;
(3)$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$为平衡常数的表达式,平衡常数只与温度有关,该反应为吸热反应,据此选择;
(4)为了提高生产效率和产量,从速率角度考虑,可增大压强,升高温度,使用催化剂,从平衡角度考虑,可增大压强,减小生成物浓度,原料气循环利用等,综合考虑,可使用催化剂、高压、将产物液化分离、原料气循环利用等;
(5)CO为反应1的生成物,随着时间的加长,CO的浓度增大,达到平衡时不变,CH3OH的浓度开始增大,后因容器内压强减小,且反应1生成的水都使反应3的平衡逆向移动,CH3OH的浓度减小,据此画图.
解答 解:(1)曲图l可知,随着温度升高,K1增大,K2、K3减小,则△H1>0,△H2<0、△H3<0,根据盖斯定律得△H3=△H1+△H2,所以△H2<△H3,
故答案为:小于;曲图l可知,随着温度升高,K1增大,则△H1>0,根据盖斯定律得△H3=△H1+△H2,所以△H2<△H3;
(2)反应1是吸热反应,可自发进行,熵值必然增大.△S1>0.△G=△H-T△S,△G<0时,反应可自发进行.△H>0,△S>0,只有当T较大时,△G<0,故答案为:>;较高温度;
(3)$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$为平衡常数的表达式,平衡常数只与温度有关,该反应为吸热反应,升高温度,平衡常数增大,故选A;
(4)为了提高生产效率和产量,从速率角度考虑,可增大压强,升高温度,使用催化剂.从平衡角度考虑,可增大压强,减小生成物浓度.原料气循环利用等,综合考虑,可使用催化剂、高压、将产物液化分离、原料气循环利用等,
故答案为:使用催化剂、高压、将产物液化分离、原料气循环利用;
(5)CO为反应1的生成物,随着时间的加长,CO的浓度增大,达到平衡时不变.CH3OH的浓度开始增大,后因容器内压强减小,且反应1生成的水都使反应3的平衡逆向移动,CH3OH的浓度减小,据此画出的图为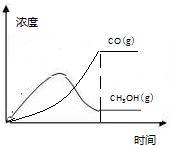 ,
,
故答案为: .
.
点评 本题考查了盖斯定律、平衡常数与温度的关系、影响反应的方向的因素、反应速率、平衡的影响因素在生产、生活中的应用等,综合性较强,难度中等,解题的关键要抓住外界条件对平衡的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
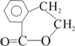 ;E
;E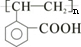 ;
;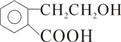 +O2
+O2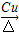 2
2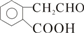 +2H2O;
+2H2O;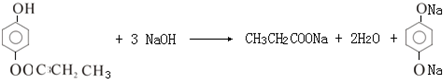 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)小 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 | |
| C. | 25℃时,在等体积等浓度的氨水、NH4Cl溶液中,Mg(OH)2的Ksp前者小于后者 | |
| D. | 25℃时,在MgF2的悬浊液中通入少量的HF气体,c(Mg2+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用催化剂可将汽车尾气中的NO、CO转化为无毒的气体 | |
| B. | 化石燃料的过量使用加剧了雾霾天气及空气中的PM2.5 | |
| C. | 小苏打是制作馒头和面包的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 蛋白质溶液中加入饱和Na2SO4溶液或CuSO4溶液,析出固体原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
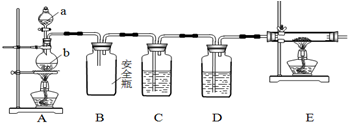
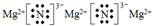 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷燃烧 | |
| B. | 乙烯通入酸性高锰酸钾溶液中 | |
| C. | 在镍做催化剂的条件下,苯与氢气反应 | |
| D. | 乙烷与氯气在光照下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp(CaF2)随浓度的变化而变化 | |
| B. | 上述混合体系中有CaF2沉淀生成 | |
| C. | 25℃时,0.1mol/L的HF溶液的pH=l | |
| D. | 上述反应的离子方程式为:Ca2++2F-=CaF2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C3H8O | C. | C2H4O2 | D. | CH2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com