
| A. | K、L、M、N | B. | s、p、d、f | C. | px、py、pz | D. | ↑、↓ |
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
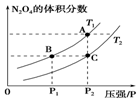 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.945795506 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
| A. | x=1.6 | |
| B. | 实验 1 在前 6min 的反应速率 v(SO2)=0.2mol•L-1•min-1 | |
| C. | T1、T2的关系:T1>T2 | |
| D. | K1、K2的关系:K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
| 第三次 | 10.00 | 0.40 | 21.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③④ | B. | 只有③⑤ | C. | 只有①④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
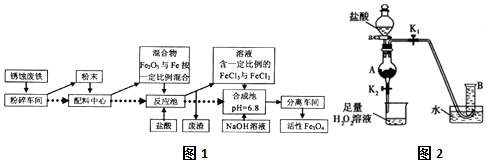
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com