
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| △c |
| t |
| △c |
| t |
| 0.67-0.57 |
| 10 |


科目:高中化学 来源: 题型:
| A、KHCO3 |
| B、K2CO3和Na2CO3 |
| C、MgCO3和Na2CO3 |
| D、Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:2 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯塑料的老化是由于发生了加成反应 |
| B、合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
C、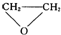 和CO2反应生成可降解聚合物[O-CHCH2-O-CO]n,该反应符合绿色化学的原则 和CO2反应生成可降解聚合物[O-CHCH2-O-CO]n,该反应符合绿色化学的原则 |
| D、煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、197>Q1>Q2 |
| B、Q1>2Q3 |
| C、Q1=Q4 |
| D、Q3<Q4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
浓度 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N204)/mol?L-1 | 0.1 | c1 | 0.05 | c3 | c3 | c3 |
| c(N02)/mol?L-1 | 0 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
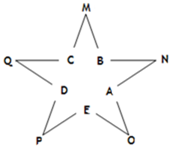 今有A、B、C、D、E五种常见单质,且相邻的单质可生成对应的化合物M、N、O、P、Q(反应关系如图所示),常温下A呈气态,其余均为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸.试回答下列问题:
今有A、B、C、D、E五种常见单质,且相邻的单质可生成对应的化合物M、N、O、P、Q(反应关系如图所示),常温下A呈气态,其余均为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com