
| A. | x+10 | B. | x+26 | C. | x-34 | D. | x-24 |
分析 由元素周期表结构,对于处于ⅠA、ⅡA元素而言,同主族原子序数之差为上一周期元素的种类数;对于其他主族,同主族原子序数之差为下一周期元素的种类数,以此来解答.
解答 解:由元素周期表结构,对于处于ⅠA、ⅡA元素而言,同主族原子序数之差为上一周期元素的种类数;对于其他主族,同主族原子序数之差为下一周期元素的种类数,同一主族不同周期的元素,原子序数相差可能为2、8、18、32等或它们的组合,如10、26\34等,不可能相差24,
故选D.
点评 本题考查元素周期表结构及其应用,明确元素周期表结构及同一主族元素原子序数之间的关系是解本题关键,注意周期表中第IIA族和第IIIA之间有副族元素和第VIII族元素,还要注意同一主族元素不一定相邻,要根据题目判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
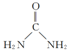 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
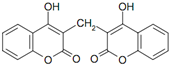
| A. | 分子式为C19H10O6 | |
| B. | 遇FeCl3溶液能发生显色反应 | |
| C. | 1 mol双羟香豆素最多能与含 4 mol氢氧化钠的水溶液完全反应 | |
| D. | 1 mol双羟香豆素最多能与 10 mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3Cl2(g)+8NH3(g)═6NH4Cl(s)+N2(g)在常温下能自发进行,则该反应的△H<0 | |
| B. | 电解精炼铜时,电解液中CuSO4的物质的量浓度不变 | |
| C. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
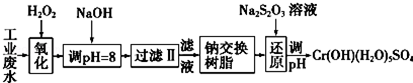
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O2(g)的能量一定高于2mol SO2(g)的能量 | |
| B. | 2mol SO2(g)和1mol O2(g)的总能量一定高于2mol SO3(g)的总能量 | |
| C. | 2mol SO2(g)的能量一定高于2mol SO3(g)的能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
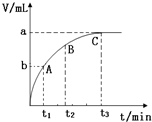 某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水任意部分味道相同 | B. | 氯化铁溶液为浅绿色 | ||
| C. | 水不是混合物所以不是溶液 | D. | 在溶液中进行反应时速度较快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com