
【题目】按系统命名法填写下列有机物的名称及有关内容。
(1)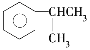 名称是______________________。
名称是______________________。
(2)![]() 分子式为__________。名称是__________,1 mol该烃完全燃烧耗O2__________mol。
分子式为__________。名称是__________,1 mol该烃完全燃烧耗O2__________mol。
(3)分子式为C4H8的所有烯烃(不包括顺反异构)的结构简式及名称___________________________。
(4)![]() 名称是_____________。
名称是_____________。
(5)新戊烷以系统命名法命名为___________。
【答案】异丙基苯 C6H10 4-甲基-2-戊炔 8.5 CH2=CHCH2CH3,名称为1-丁烯;CH3CH=CHCH3,名称为2-丁烯;CH2=C(CH3)2,名称为2-甲基-1-丙烯 环癸烷 2,2-二甲基丙烷
【解析】
结合有机物的系统命名法命名或写出各有机物的结构简式。
(1)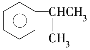 名称是异丙基苯;
名称是异丙基苯;
(2) 中C、H原子数缩小即得到分子式为C6H10;该炔烃的最长碳链含有5个碳原子,含有1个甲基,从离碳碳三键最近的碳原子编号,命名为:4-甲基-2-戊炔;1 mol该烃完全燃烧耗O2的物质的量为1mol×(6+![]() )=8.5mol;
)=8.5mol;
(3) C4H8且属于烯烃的有机物结构有:CH2=CHCH2CH3,名称为1-丁烯;CH3CH=CHCH3,名称为2-丁烯;CH2=C(CH3)2,名称为2-甲基-1-丙烯;
(4)![]() 是10个碳原子的环烷烃,其名称是环癸烷;
是10个碳原子的环烷烃,其名称是环癸烷;
(5) 新戊烷的结构简式为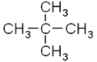 ,根据系统命名法命名为:2,2-二甲基丙烷。
,根据系统命名法命名为:2,2-二甲基丙烷。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示。下列有关溶液中粒子浓度关系的描述中,错误的是( )
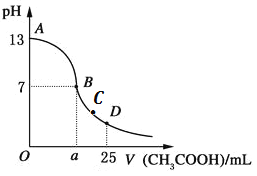
A. 在A、B间可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 在B点:a =12.5,且有c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-) > c(Na+) >c(H+)>c(OH-)
D. 在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
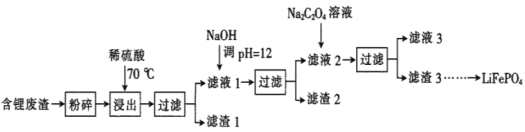
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
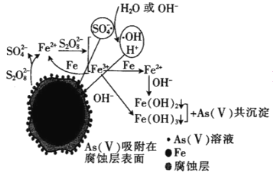
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
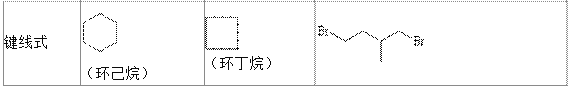
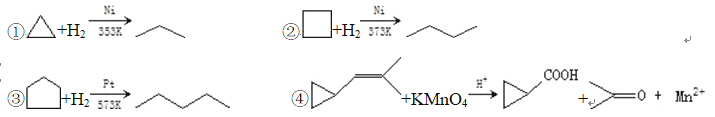
【题目】环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂,下面是部分环烷烃及烷烃衍生物的 结构简式、键线式和某些有机化合物的反应式(其中 Pt、Ni 是催化剂)。

回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是____________(填名称)。判断依 据为____________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与 HBr 在一定条件下反 应,其化学方程式为____________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法.试剂____________;现象与结论____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的结构简式。
(1)3,4二甲基3乙基庚烷___________________________。
(2)3乙基2辛烯___________________________。
(3)对甲基苯乙烯___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如图,具有生物活性,如抗氧化和自由基清除能力等。有关原花青素的下列说法不正确的是
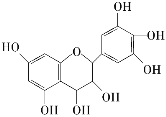
A. 该物质可以看作醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质分子式都是C7H8O,若滴入FeCl3 溶液,只有C呈紫色;若投入金属钠,只有B没有变化。在A、B中分别加入溴水,溴水不褪色。
(1)写出A、B、C的结构简式: A:__________________; B:___________________;C:____________________。
(2)C的另外两种同分异构体的结构简式是: ①__________________;②______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒和碲在工业上有重要用途。在铜、镍镇、铅等电解工艺的阳极泥中硒、碲确主要以硒化物、碲化物及单质状态存在。一种从阳极泥中提取Se和Te的工艺流程如下:
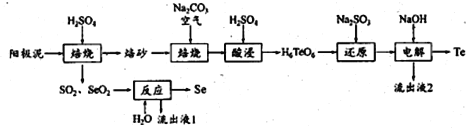
已知:碲酸四氢钠(Na2H4TeO6)难溶,碲酸(H6TeO6)可溶。回答下列问题:
(1)阳极泥在600K左右加入一定浓度H2SO4焙烧时,,单质Te转化为TeO2 的化学方程式为_______________。
(2)“焙砂”与碳酸钠充分混合,干燥后通入空气焙烧,发生氧化反应,每生成1mol碲酸四氢钠(Na2H4TeO6),则需要的氧化剂O2至少为______mol;生成的碲酸四氢钠不用“水浸”,而采取“酸浸”的原因是____________。
(3)流程中“反应”处发生反应的化学方程式为________________________________。
(4)检验“还原”后的溶液中Na2SO3是否过量的实验操作方法为___________________________________。
(5)工艺路线中可以循环利用的物质有_________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子排布式为3s23p4的粒子的描述正确的是( )
A. 它的原子核外有三种形状不同的电子云
B. 它的原子核外电子共有16种不同的运动状态
C. 它可与H2反应生成常温时的液态化合物
D. 该原子的轨道表示式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com