
 南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破.请根据材料回答以下问题:
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破.请根据材料回答以下问题: .
.分析 (1)同周期自左而右元素第一电离能呈增大趋势,但N元素原子的2p能级含有3个电子,处于半满稳定状态,能量较低,失去第1个电子需要的能量较大;等电子体为原子数和电子数相同的分子或离子团;原子晶体中原子间通过共价键形成空间网状结构,原子晶体的沸点高于分子晶体;由同种元素组成的不同单质互称同素异形体;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价,配位体:提供孤电子对的分子或离子;根据价电子对互斥理论确定微粒SO42-的空间构型,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb);
(3)A.HNO2为弱酸,而HNO3是强酸;
B.N2H4中氮原子最外层有5个电子,氮原子采用的都是sp3杂化;
C.结构相似的离子晶体中,晶格能与离子半径呈反比;
D.肼和亚硝酸(HNO2)反应时发生归中反应生成氢叠氮酸(HN3),H和O元素未发生氧化还原反应,据此书写化学方程式;
(4)N5结构是对称的,5个N排成V形,5个N结合后都达到8电子结构,且含有2个N≡N键,满足条件的结构为: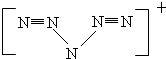 ,故“N5”带一个单位正电荷,根据结构式写出电子式.
,故“N5”带一个单位正电荷,根据结构式写出电子式.
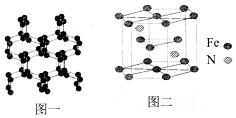
(5)晶胞中N原子处于体心,Fe原子处于顶点与面心,利用均摊法计算原子数目,进而确定化学式,结合晶胞中含有原子数目表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算.
解答 解:(1)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素O,故第一电离能F>N>O,N2中含有2个原子、14个电子数,则与N2等电子体的全氧离子化学式为O22+,原子晶体中原子间通过共价键形成空间网状结构,已知高聚氮的结构如图1所示,它具有空间网状结构,所以高聚氮属于原子晶体,原子晶体的沸点高于分子晶体N70,则N70的沸点<高聚氮的沸点,N70和高聚氮都是氮元素组成的单质,属于同素异形体,
故答案为:F>N>O;O22+;<;N70是分子晶体,高聚氮是原子晶体;A;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,设钴的化合价为+x,+x+(-1)+(-2)=0,解得x=+3价,它的配体是N3-、NH3,SO42-中,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb)=4+$\frac{1}{2}$(6+2-4×2)=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化,分子形状为正四面体形,
故答案为:+3;N3-、NH3;正四面体形;
(3)A.HNO2为弱酸,而HNO3是强酸,酸性:HNO3>HNO2,故A错误;
B.N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B正确;
C.NaN3与KN3的结构类似,钠离子半径小于钾离子半径,所以NaN3的晶格能>KN3的晶格能,故C错误;
D.肼和亚硝酸(HNO2)反应时发生归中反应生成氢叠氮酸(HN3),H和O元素未发生氧化还原反应,故化学方程式为N2H4+HNO2═HN3+2H2O,故D正确;
故答案为:BD;
(4)由5个N结合,都达到8电子结构,且含有两个N≡N三键,故N≡N只能在链端,其结构为 ,两个N-N为配位键,电子对由靠近三键的N提供,故中间的N原子需失去一个电子达到稳定结构,所以N5分子碎片所带电荷是+1;由其结构式写出电子式为:
,两个N-N为配位键,电子对由靠近三键的N提供,故中间的N原子需失去一个电子达到稳定结构,所以N5分子碎片所带电荷是+1;由其结构式写出电子式为: ,
,
故答案为: ;
;
(5)晶胞中N原子处于体心,含有2个氮原子,Fe原子处于顶点与面心、体心,Fe原子个数为12×$\frac{1}{6}$+2×$\frac{1}{2}$+3=6,图中六棱柱的体积为Vcm3,则晶胞的密度为ρ=$\frac{m}{V}$=$\frac{364}{V{N}_{A}}$g/cm3.
故答案为:$\frac{364}{V{N}_{A}}$g/cm3.
点评 本题是对物质结构与性质的考查,涉及电离能、等电子体、配合物、电子式、晶胞计算等,注意掌握均摊法进行有关晶胞计算,理解根据价层电子对互斥理论判断立体构型问题,侧重于考查学生对基础知识的应用能力和对知识的迁移能力,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃 名称为3,5-二甲基-4-乙基己烷 名称为3,5-二甲基-4-乙基己烷 | |
| B. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| C. | 有机物 CH3CH2CH(CH3)2 的一氯代物有 4 种 | |
| D. | 葡萄糖可以进一步水解成两分子乳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取氯代烃少许,加入AgNO3溶液 | |
| B. | 取氯代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取氯代烃少许与NaOH水溶液共热后,加入稀硝酸酸化,再加入AgNO3 | |
| D. | 取氯代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:
过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题: .
.| 实验编号 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 25℃ | 三氧化二铁 | 10mL5%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃是用于生产硅胶、木材防火剂、粘合剂的原料 | |
| B. | 可以用氢氧化钠溶液鉴别地沟油和矿物油 | |
| C. | CaCO3分解,Ba(OH)2•8H2O和NH4Cl 反应,高温下铝与氧化铁的反应都是吸热反应 | |
| D. | 淀粉、蛋白质、有机玻璃、天然橡胶都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
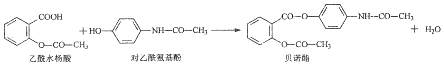
| A. | 贝诺酯分子中有2种含氧官能团 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | lmol乙酰水杨酸最多消耗3molNaOH | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氮基酚钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com