
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:
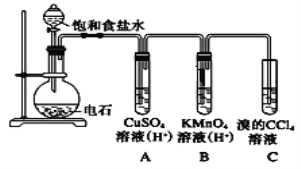
(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________________
(2)用饱和食盐水代替蒸馏水的目的是__________________
(3)装置A的作用是_______________,装置B中的现象是__________________
(4)如果要进行乙炔的可燃性实验,首先应该__________________。
(5)若乙炔加氢后得到乙烷,则乙烷在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(6)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为___________(用百分数表示)
【答案】CaC2+2H2O→Ca(OH)2+HC≡CH↑ 减慢反应速率 除H2S等气体 紫色溶液褪色 检验纯度或验纯 1种 ![]() ×100%或 64b/26a×100%
×100%或 64b/26a×100%
【解析】
电石和水制取乙炔,由于电石中会混有硫、磷等杂质,所以生成的乙炔中会混有硫化氢、磷化氢等化合物,导致生成的乙炔有特殊难闻的臭味,硫酸铜溶液可以除去硫化氢和磷化氢。乙炔可以使酸性高锰酸钾溶液褪色,也可以和溴发生加成反应。
(1)电石(碳化钙CaC2)与水制取乙炔的化学方程式为:CaC2+2H2O→Ca(OH)2+HC≡CH↑。
(2)电石和水反应非常剧烈,可以用饱和食盐水代替蒸馏水减慢反应速率。
(3)硫酸铜和H2S可以发生复分解反应从而除去H2S:H2S+CuSO4=CuS↓+H2SO4。乙炔能把酸性高锰酸钾溶液还原成Mn2+,所以高锰酸钾溶液的紫色会褪去。
(4)乙炔是可燃性气体,如果点燃不纯的乙炔,会发生爆炸,所以在点燃乙炔前,首先应该检验乙炔的纯度。
(5)乙烷中的6个氢原子是等效氢原子,乙烷在光照条件下与氯气反应,生成的一氯代烷只有1种。
(6)乙炔全部通入足量溴的CCl4溶液中,乙炔和溴发生加成反应,溶液增重的b g即为生成的乙炔的质量,所以乙炔的物质的量为![]() mol,根据反应方程式CaC2+2H2O→Ca(OH)2+HC≡CH↑,乙炔和碳化钙的物质的量相等,所以碳化钙的质量为
mol,根据反应方程式CaC2+2H2O→Ca(OH)2+HC≡CH↑,乙炔和碳化钙的物质的量相等,所以碳化钙的质量为![]() ×64g,则CaC2的纯度为
×64g,则CaC2的纯度为![]() ×100%或 64b/26a×100%。
×100%或 64b/26a×100%。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】在一密闭体系中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
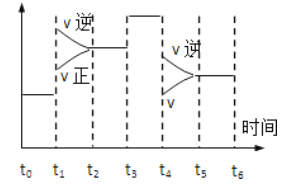
(1)处于平衡状态的时间段是__.
(2)t1、t3、t4时刻体系中分别改变的是什么条件?
t1:__,t3:__,t4:__.
(3)下列各时间段时,氨的体积分数最高的是______。
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
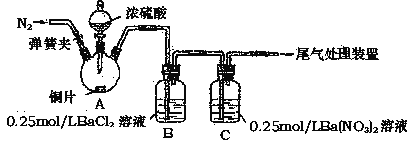
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | -------------------------------------------------- |
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是__________________________________________。
(2)C中白色沉淀是_________,该沉淀的生成表明SO2具有_________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为是白雾参与反应。
①为证实各自的观点,在原实验基础上,甲同学在原有操作之前增加一步操作,该操作是_____________;乙同学在A、B间增加洗气瓶D,D中盛放的试剂是____________。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲:___________________,乙:__________________。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)G的分子式是________。
(2)③的反应试剂和反应条件分别是________________,该反应的类型是________。
(3)⑤的反应方程式为________,吡啶是一种有机碱,其作用是________。
(4)G中所含官能团的名称为________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )与乙酰氯(
)与乙酰氯(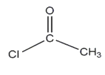 )制备4-甲氧基乙酰苯胺的合成路线(其他无机试剂任选);________________
)制备4-甲氧基乙酰苯胺的合成路线(其他无机试剂任选);________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图象的说法中,不正确的是![]()
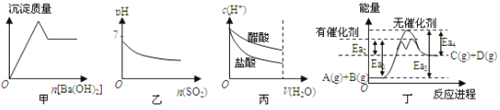
A.甲是向![]() 溶液滴加
溶液滴加![]() 时,沉淀质量与
时,沉淀质量与![]() 物质的量的关系图
物质的量的关系图
B.乙是向溴水通入![]() 气体时,pH与
气体时,pH与![]() 物质的量的关系图
物质的量的关系图
C.丙是向![]() 相同的醋酸和盐酸滴入水时,
相同的醋酸和盐酸滴入水时,![]() 与水体积的关系图
与水体积的关系图
D.由丁可知,A与B在有催化剂存在的热化学方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.工业上利用二氧化硅和焦炭在高温下反应制得单质硅和二氧化碳的原理制取粗硅
B.海水是一个巨大的宝藏,氯、溴、碘、硫、钠、钾等重要元素主要来自于海水
C.工业上利用![]() 和
和![]() 光照下反应生成HCl,再将其溶于水生产盐酸
光照下反应生成HCl,再将其溶于水生产盐酸
D.高炉炼铁得到的铁是含碳![]() 的生铁,通过炼制生铁可以得到用途更广泛的钢,钢的含碳量比生铁低
的生铁,通过炼制生铁可以得到用途更广泛的钢,钢的含碳量比生铁低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼![]() 是一种难熔稀有金属,我国的钼居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
是一种难熔稀有金属,我国的钼居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:![]()
![]()
![]() ,则
,则![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]()
(2)密闭容器中用![]() 作固硫剂,同时用一定量的氢气还原辉钼矿
作固硫剂,同时用一定量的氢气还原辉钼矿![]() 的原理是:
的原理是:![]() ,实验测得平衡时的有关变化曲线如图所示:
,实验测得平衡时的有关变化曲线如图所示:
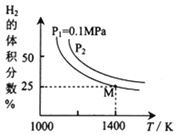
![]() 由图可知,该反应的
由图可知,该反应的![]() ______0
______0![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,
,![]() ______
______![]() MPa
MPa![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______
如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______![]() 选填编号
选填编号![]() 。
。
A.![]()
![]() 容器内气体的密度不变时,一定达平衡状态
容器内气体的密度不变时,一定达平衡状态
C.再加入![]() ,则
,则![]() 转化率增大
转化率增大![]() 容器内压强不变时,一定达平衡状态
容器内压强不变时,一定达平衡状态
(3)电氧化法提纯钼的原理:将辉钼矿![]() 放入装有食盐水的电解槽中,用惰性电极电解,
放入装有食盐水的电解槽中,用惰性电极电解,![]() 被氧化为
被氧化为![]() 和
和![]() 阴极的电极反应式为______。
阴极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3.有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | ________ |
② | ________ | ________ | 1 | 0.5a |
③ | m | g(g=4m) | 0 | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K、1.01×105 Pa,将22 g CO2通入0.75 L 1.0 mol·L-1NaOH溶液中充分反应,测得反应放出的热量为a kJ。已知该条件下1 mol CO2通入1 L 2.0 mol·L-1NaOH溶液中充分反应放出的热量为b kJ。则CO2与NaOH反应生成NaHCO3的热化学方程式为( )。
A. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
B. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
C. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
D. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com